题目内容
17. 实验室有一瓶未开封的浓盐酸,部分标签如图所示.
实验室有一瓶未开封的浓盐酸,部分标签如图所示.(1)这瓶浓盐酸是多少克?
(2)若用这瓶浓盐酸来配制200克溶质质量分数为10%的稀盐酸,需量取浓盐酸多少毫升?(保留整数)
(3)需加水多少克?
分析 (1)根据浓盐酸的商标,结合m=ρV,进行分析解答.
(2)根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.
(3)根据水的质量=稀溶液的质量-浓溶液的质量,进行分析解答.
解答 解:(1)这瓶浓盐酸中溶液的质量是1.18g/cm3×500cm3(即500mL)=590g.
(2)设量取浓盐酸的体积是x,根据溶液稀释前后,溶质的质量不变,
则200g×10%=1.18g/cm3×x×37% x≈46cm3(46mL).
(3)需要加入水的质量为200g-1.18g/cm3×46cm3=145.72g.
答:(1)这瓶浓盐酸是590g;(2)需量取浓盐酸46mL;(3)需加水145.72g.
点评 本题难度不大,掌握溶质质量=溶液质量×溶质的质量分数、溶液稀释前后溶质的质量不变是正确解答本题的关键.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
7.美琪同学家新换了水龙头,她从说明书上了解到该水龙头是铜质镀铬材料.出于好奇,美琪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参与.
【知识回放】
金属活动性顺序:K Ca Na Mg Al ZnFeSn Pb(H)CuHgAg Pt Au,(请你在横线上填写对应金属的元素符号).
【作出猜想】
猜想一:Cr>Fe>Cu
猜想二:Fe>Cu>Cr
猜想三:Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
【设计与实验】
美琪取形状大小相同的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸,将三种金属片分别放入试管中,观察现象.
【结论与解释】
(1)美琪得到的正确结论是猜想一.
(2)实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜.
【知识运用】
(1)将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.
(2)写出探究铬、铁、铜的活动性强弱的另外两组试剂:硫酸铬溶液、铁、硫酸铜溶液;铬、铜、硫酸亚铁溶液.(每一组仅限三种试剂)
【知识回放】
金属活动性顺序:K Ca Na Mg Al ZnFeSn Pb(H)CuHgAg Pt Au,(请你在横线上填写对应金属的元素符号).
【作出猜想】
猜想一:Cr>Fe>Cu
猜想二:Fe>Cu>Cr
猜想三:Fe>Cr>Cu.
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜.
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液.
【设计与实验】
美琪取形状大小相同的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸,将三种金属片分别放入试管中,观察现象.
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验操作 |  |  |  |
| 实验现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变为蓝色 | 无明显现象 |
(1)美琪得到的正确结论是猜想一.
(2)实验前用砂纸打磨金属片的目的是除去金属表面的氧化膜.
【知识运用】
(1)将铬片投入FeSO4溶液中,反应能(填“能”或“不能”)进行.
(2)写出探究铬、铁、铜的活动性强弱的另外两组试剂:硫酸铬溶液、铁、硫酸铜溶液;铬、铜、硫酸亚铁溶液.(每一组仅限三种试剂)
6.对下列微粒的叙述是正确的是( )
| A. | 物质都是由分子组成的 | |
| B. | 分子在不断的运动,原子不动 | |
| C. | 原子中质子数等于电子数 | |
| D. | 原子失去了电子,带负电荷,成为阴离子 |
7. 如图所示装置可用于洗气、集气、验气和储气等多种用途(视实验需要,瓶中可装入不同物质).下列四个实验中均要使用该装置,则气体或水入口为y的是( )
如图所示装置可用于洗气、集气、验气和储气等多种用途(视实验需要,瓶中可装入不同物质).下列四个实验中均要使用该装置,则气体或水入口为y的是( )
 如图所示装置可用于洗气、集气、验气和储气等多种用途(视实验需要,瓶中可装入不同物质).下列四个实验中均要使用该装置,则气体或水入口为y的是( )
如图所示装置可用于洗气、集气、验气和储气等多种用途(视实验需要,瓶中可装入不同物质).下列四个实验中均要使用该装置,则气体或水入口为y的是( )| A. | 瓶中装有适量的NaOH溶液,除去氢气中含有的少量二氧化碳气体 | |
| B. | 瓶中装满水,用排水集气法收集氧气 | |
| C. | 瓶中装有澄清石灰水,检验一氧化碳气体中是否混有二氧化碳 | |
| D. | 瓶中装有氧气,将水从导气管通入以取用瓶内储存的气体 |
 某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验:
某化学兴趣小组在做Fe和CuSO4溶液反应实验时,发现生成Cu的同时有气泡产生.为了进一步研究做了如下实验: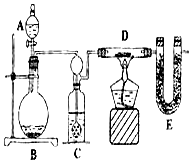 某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.
某同学为了测定水中氢、氧两元素的质量比,设计了以下实验,实验装置如图.

 用如图微型仪器完成制取并检验CO2的实验只消耗了0.55g 10%的盐酸.求:
用如图微型仪器完成制取并检验CO2的实验只消耗了0.55g 10%的盐酸.求: