题目内容
11.甲、乙、丙3种常见物质,由氢、氧、氯、钙、铁5种元素中的2~3种组成.(1)甲俗称熟石灰,其化学式为Ca(OH)2.
(2)乙溶液有刺激性气味,与固体丙反应后溶液变黄,写出该反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(3)试管中盛有某红色溶液,滴加甲溶液,溶液变浑浊;再加入过量的乙溶液,观察到产
生无色气泡,溶液又变澄清,且由红色变为无色.
①试管内最初盛放溶液的溶质是碳酸钠和酚酞.
②用化学方程式表示溶液变浑浊的原因Ca(OH)2+Na2CO3═2NaOH+CaCO3↓.
③最终所得溶液中溶质的组成为HCl、NaCl、CaCl2.
分析 已知“甲、乙、丙3种常见物质,由氢、氧、氯、钙、铁5种元素中的2~3种组成”,则:
(1)根据“甲俗称熟石灰”,写出化学式;
(2)根据“乙溶液有刺激性气味,与固体丙反应后溶液变黄”,推测乙为稀盐酸,丙为氧化铁,进行书写化学方程式;
(3)根据碳酸钠的溶液为碱性;氢氧化钙与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠;氢氧化钠与稀盐酸反应生成氯化钠和水,碳酸钙与稀盐酸反应生成氯化钙和水和二氧化碳,因为“加入过量的乙溶液”,进行分析.
解答 解:已知“甲、乙、丙3种常见物质,由氢、氧、氯、钙、铁5种元素中的2~3种组成”,则:
(1)因为甲俗称熟石灰,为氢氧化钙,则其化学式为Ca(OH)2.
(2)根据“乙溶液有刺激性气味,与固体丙反应后溶液变黄”,推测乙为稀盐酸,丙为氧化铁,则该反应的化学方程式Fe2O3+6HCl═2FeCl3+3H2O.
(3)根据“试管中盛有某红色溶液,滴加甲溶液,溶液变浑浊;再加入过量的乙溶液,观察到产
生无色气泡,溶液又变澄清,且由红色变为无色”,则推测:
①因为碳酸钠的溶液为碱性,故试管内最初盛放溶液的溶质是碳酸钠和酚酞.
②因为氢氧化钙与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,故用化学方程式表示溶液变浑浊的原因为Ca(OH)2+Na2CO3═2NaOH+CaCO3↓.
③因为氢氧化钠与稀盐酸反应生成氯化钠和水,碳酸钙与稀盐酸反应生成氯化钙和水和二氧化碳,因为“加入过量的乙溶液”,故最终所得溶液中溶质的组成为HCl、NaCl、CaCl2.
故答案为:
(1)Ca(OH)2;(2)Fe2O3+6HCl═2FeCl3+3H2O;
(3)①碳酸钠和酚酞;②Ca(OH)2+Na2CO3═2NaOH+CaCO3↓;③HCl、NaCl、CaCl2.
点评 本题的推断由组成物质的元素做为限定条件,因此,熟悉常见物质的组成、性质及变化规律对该题中所涉及物质的推断就至关重要了.

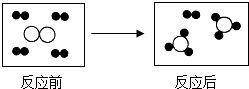
| A. | 反应后生成两种物质 | |
| B. | 参加反应各物质的分子个数比为1:4 | |
| C. | 反应前后原子的种类没有改变 | |
| D. | 该反应的基本类型是置换反应 |
| A. | 氧气作燃料 | B. | 干冰用于人工降雨 | ||
| C. | 氢氧化钠用于改良酸性土壤 | D. | 甲醛用于泡发鱿鱼等水产品 |
| A. |  | B. |  | C. |  | D. |  |
| A. |  加热液体 | B. |  检查装置气密性 检查装置气密性 | C. |  蒸发食盐水 | D. |  稀释浓硫酸 |
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度 g/100gH2O | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
②碳酸钠溶液中混有少量的氯化钠,可通过降温结晶(或冷却热的饱和溶液)的方法提纯;
③碳酸钠的溶解度随温度的升高而增大(填“增大”或“减小”).在20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到的是饱和(填“饱和”或“不饱和”)溶液,将上述溶液升温到30℃,该溶液的溶质质量分数为23.1%.
| A. |  滴加液体 | B. |  量取液体体积读数 | ||
| C. |  二氧化碳验满 | D. |  测定溶液的pH |