题目内容
3.现代循环经济要求综合考虑环境污染和经济效益.高纯氧化铁可作现代电子工业的材料,以下是以硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解].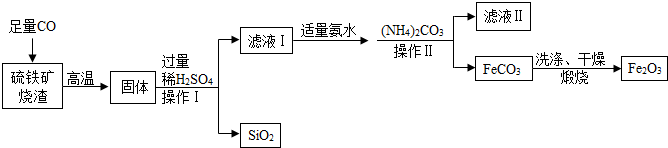
(1)写出硫铁矿灼烧后生成铁的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,或FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2(任写一个);
(2)实验过程中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有漏斗、烧杯、玻璃棒等.
(3)滤液Ⅰ中的阳离子主要是Fe2+、H+(写离子符号)等.
(4)加适量氨水的目的是除去过量的硫酸,调节溶液的酸碱度.
(4)加入(NH)4CO3后,生成两种盐,该反应的化学方程式是(NH4)2CO3+FeSO4=FeCO3+(NH4)2SO4,属于反应复分解反应(写出基本反应类型).
分析 (1)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳,和氧化亚铁反应生成铁和二氧化碳;
(2)过滤需要用到的玻璃仪器有漏斗、烧杯、玻璃棒等.
(3)滤液Ⅰ中含有反应生成的硫酸亚铁和过量的硫酸等溶质;
(4)氨水能和稀硫酸反应生成硫酸铵,同时能够调节溶液的pH;
(4)碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵.
解答 解:(1)高温条件下,一氧化碳和氧化铁反应生成铁和二氧化碳,和氧化亚铁反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,或FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
(2)实验过程中,操作Ⅰ、操作Ⅱ都是过滤,用到的玻璃仪器有漏斗、烧杯、玻璃棒等.
故填:玻璃棒.
(3)滤液Ⅰ中的阳离子主要是Fe2+、H+等.
故填:Fe2+、H+.
(4)加适量氨水的目的是除去过量的硫酸,调节溶液的酸碱度.
故填:除去过量的硫酸,调节溶液的酸碱度.
(4)碳酸铵和硫酸亚铁反应生成碳酸亚铁和硫酸铵,反应的化学方程式为:(NH4)2CO3+FeSO4=FeCO3+(NH4)2SO4,属于复分解反应.
故填:(NH4)2CO3+FeSO4=FeCO3+(NH4)2SO4;复分解反应.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
16.已知氨水的密度小于1,质量分数为25.0%的氨水与质量分数为45.0%的氨水等体积混合后,所得溶液的质量分数为( )
| A. | 等于35% | B. | 大于35% | C. | 小于35% | D. | 无法确定 |
8.某实验小组利用废硫酸液制备K2SO4
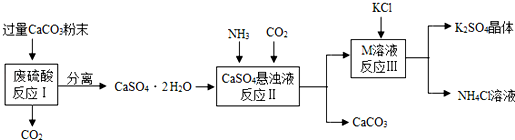
(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止硫酸钾流失;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入b(选填序号,下同),振荡、静置,再向上层清液中滴加a,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.

(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.
12.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.
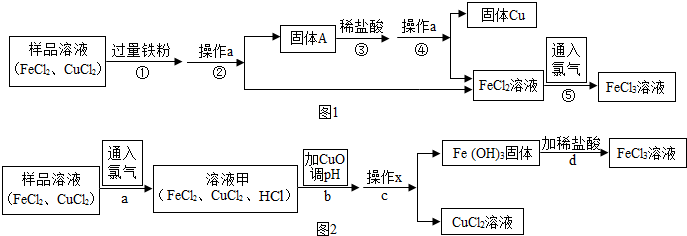
实验一:(如图1)
(1)写出步骤①中发生的化学方程式Fe+CuCl2═FeCl2+Cu,此反应的基本类型是置换反应.
(2)步骤②中的操作a名称是过滤;步骤③中加入稀盐酸的目的是除去过量的铁粉.
实验二:该实验小组同学通过查阅资料,又进行了另一种尝试.
【阅读资料】不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
(3)如图2,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;你认为步骤b调节溶液的pH到3.2~4.7(数值范围)比较合适.
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.

实验一:(如图1)
(1)写出步骤①中发生的化学方程式Fe+CuCl2═FeCl2+Cu,此反应的基本类型是置换反应.
(2)步骤②中的操作a名称是过滤;步骤③中加入稀盐酸的目的是除去过量的铁粉.
实验二:该实验小组同学通过查阅资料,又进行了另一种尝试.
【阅读资料】不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
 如图是某种粒子(原子或离子)的结构示意图
如图是某种粒子(原子或离子)的结构示意图 自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.
自行车的主要材料钢铁易生锈,请为图中标示的自行车部件各设计一种不同的、合理的防锈方法.