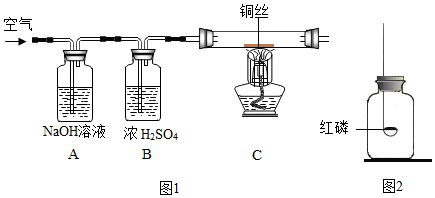
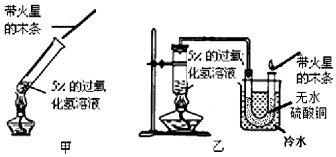
题目内容
8. 如图是实验室用氢气还原氧化铜实验的示意图.
如图是实验室用氢气还原氧化铜实验的示意图.(1)实验开始时,应该向试管中先通一会儿氢气,再用酒精灯给试管加热,这为了排净试管中的空气,以防加热时发生爆炸;
(2)反应完成时,应先停止加热,等试管冷却后再停止通氢气,这是为了防止刚被还原的铜被重新氧化.
(3)实验过程中,观察到的现象是试管中的黑色粉末慢慢变成红色,试管壁上有水珠出现;
(4)写出该反应的化学方程式CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中,氧化剂是CuO.
分析 (1)氢气为可燃性气体,氢气的爆炸极限为:4.0%~74.2%,氢气不纯时,很有可能发生爆炸.
(2)反应完成时,“先熄灯,后停氢”,因为热的铜很容易被氧化.
(3)根据实验的现象来分析;
(4)根据化学反应的原理以及化学方程式的写法来分析.
解答 解:(1)氢气还原氧化铜实验,由于反应需要加热,而装置中有空气,若不出去,将会发生爆炸,出现事故,所以实验开始时要先通入一会儿氢气,以排除装置中的空气,故填:排净试管中的空气,以防加热时发生爆炸;
(2)氢气还原氧化铜实验结束时,若先停止通氢气,受热的铜将再次被氧化,导致实验失败,所以要继续通氢气,直到铜被冷却,故填:防止刚被还原的铜被重新氧化;
(3)在加热的条件下,氧化铜被氢气还原为铜,同时生成水,所以观察到试管中的黑色粉末慢慢变成红色,试管壁上有水珠出现;故填:试管中的黑色粉末慢慢变成红色,试管壁上有水珠出现;
(4)在加热的条件下,氢气将氧化铜还原为金属铜,同时生成水,在反应中氧化铜失去氧被还原,本身是氧化剂;故填:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;CuO.
点评 本题主要考查了实验的安全性及防范,氢气还原氧化铜实验是初中化学中一个重要实验,对实验过程及设计的原因必须掌握.

练习册系列答案
相关题目
18.用图形表示某些科学知识直观、简明、易记,下列图形表示的科学知识错误的是( )
| A. | 常见金属的活动性 | B. | 某些物质的熔点 | ||
| C. | 常用燃料的热 | D. | 某些物质水溶液的pH |
19. 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
 氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )
氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应.如图所示,关于这两个反应的叙述正确的是( )| A. | 都发光发热 | B. | 生成物都是固体 | ||
| C. | 都产生蓝紫色火焰 | D. | 都是非金属和氧气反应 |
17.课上老师将一块金属钠放入燃烧匙中点燃后,再将其放入集满氯气的集气瓶中,金属钠在氯气中继续燃烧.根据这个实脸现象,能推出的结论是( )
| A. | 离子也是构成物质的基本粒子 | B. | 燃烧并不一定要有氧气 | ||
| C. | 反应产物中有氯离子 | D. | 金属和非金属反应一定生成盐 |
18.对实验现象的观察和分析,有助于获得化学知识并学会科学探究的方法.下列对实验现象的分析合理的是( )
| A. | 向某无色溶液中滴入紫色石蕊试液,呈红色,证明该溶液是酸溶液 | |
| B. | 向某无色溶液中滴入硝酸钡溶液,产生白色沉淀,证明该溶液是硫酸 | |
| C. | 某白色固体与熟石灰混合后加热,产生可使湿润的红色石蕊试纸变蓝色的气体, 证明该固体是铵盐 | |
| D. | 把燃着的木条伸入某无色气体的集气瓶中,火焰熄灭,证明该气体是二氧化碳 |
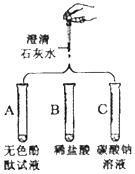 实验课上,丁丁为验证氢氧化钙的化学性质做如图所示3个实验.请回答:
实验课上,丁丁为验证氢氧化钙的化学性质做如图所示3个实验.请回答: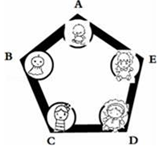 兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)
兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)