题目内容
17.课上老师将一块金属钠放入燃烧匙中点燃后,再将其放入集满氯气的集气瓶中,金属钠在氯气中继续燃烧.根据这个实脸现象,能推出的结论是( )| A. | 离子也是构成物质的基本粒子 | B. | 燃烧并不一定要有氧气 | ||
| C. | 反应产物中有氯离子 | D. | 金属和非金属反应一定生成盐 |
分析 燃烧通常是指可燃物与氧气发生的剧烈的发光、放热的化学反应.有题目可以推出:在特定条件下燃烧不需要氧气参加.
解答 解:A、离子也是构成物质的基本粒子,但是不能由该实验现象推出.故选项错误;
B、根据金属钠在氯气中继续燃烧实验现象可知,燃烧不一定需要氧气参加.故选项正确;
C、反应产物中有氯离子,但是不能由该实验现象推出.故选项错误;
D、金属和非金属反应不一定生成盐,例如铁和氧气反应生成的四氧化三铁不属于盐.故选项错误.
故选B.
点评 解答本题要充分理解实验现象反映的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.下列固体在空气中易潮解,并能吸收空气中的CO2,该产物的晶体在干燥的空气中会风化的是( )
| A. | NaCl | B. | 生石灰 | C. | 烧碱 | D. | 纯碱 |
9.下列符号既表示一种元素,又表示一个原子,还表示一种物质的是( )
| A. | 2N | B. | O | C. | SO2 | D. | Zn |
7.下列实验操作正确的是(??)
| A. |  收集二氧化碳并验满 | B. |  加热液体 | ||
| C. |  取用液体 | D. |  收集氧气 |
 如图是实验室用氢气还原氧化铜实验的示意图.
如图是实验室用氢气还原氧化铜实验的示意图.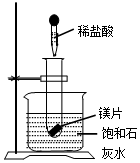 (1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.
(1)向试管中放入几小粒镁片,把试管底部伸入盛有饱和石灰水(20℃的烧杯中并固定,再向试管中滴入约5ml盐酸,如图所示,结果澄清的饱和石灰水明显变浑浊,这个实验现象产生原因是镁与盐酸反应放出热量使石灰水的温度升高,氢氧化钙的溶解度随温度的升高减小,所以会析出晶体.