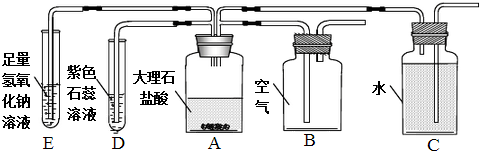
题目内容
17.二氧化硫是一种无色具有刺激性气味的气体,它进入大气后可形成硫酸型酸雨,为减少大气污染,火力发电厂采用石灰石浆吸收废气中的二氧化硫,其反应原理是:2CaCO3+O2+2SO2 $\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.若1000kg废气中含有1.6kg的二氧化硫,则至少需要含90%碳酸钙的石灰石多少千克才能将其完全吸收(写出解题过程,计算结果保留一位小数)?分析 根据反应的化学方程式和二氧化硫的质量可以计算需要碳酸钙的质量进行解答.
解答 解:设至少需要含90%的碳酸钙的石灰石的质量为x
2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2
200 128
90%×x 1.6kg
$\frac{200}{90%×x}=\frac{128}{1.6kg}$
x=2.8kg
答:至少需要含90%的碳酸钙的石灰石的质量为2.8kg.
点评 本题主要考查学生化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列物质在溶液中能够大量共存,且形成无色溶液的是( )
| A. | CaCl2、NaOH、K2CO3、Ba(NO3)2 | B. | FeCl3、H2SO4、KCl、NaNO3 | ||
| C. | NaCl、KCl、NH4NO3、Na2SO4 | D. | Mg(NO3)2、CuSO4、NaCl、KNO3 |
8.我国研制的航天员舱外服为航天员成功进行太空行走提供了可靠的保证.航天员舱外服内含有与氢氧化钠性质相似的氢氧化锂(LiOH),它不可能具有的性质是( )
| A. | 能与二氧化碳反应 | B. | 能与盐酸反应 | ||
| C. | 能与氧化铁反应 | D. | 能使酚酞变红 |
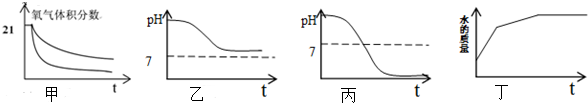
12.如图是甲、乙、丙三种物质的溶解度曲线.下列说法错误的是( )


| A. | 要配制相同质量分数的甲、丙两种物质的饱和溶液,应该将温度控制在t1℃ | |
| B. | 要从甲物质的饱和溶液中获得晶体甲,可以采用降温结晶的方法 | |
| C. | t2℃时,30g甲物质加入到50g水中不断搅拌,形成的溶液中溶质的质量分数是37.5% | |
| D. | t1℃时,将三种物质的饱和溶液升温至t2℃,所得溶液中溶质质量分数乙>甲>丙 |
6.下列图形中,可表示塑料包装制品回收标志的是( )
| A. |  | B. |  | C. |  | D. |  |
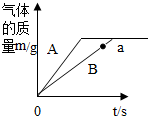 A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.
A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.