题目内容
6.现有X、Y、Z三种金属,把X、Y分别放入稀盐酸中,Y产生气体的速率比X快,把Z放入硫酸铜溶液中,一段时间后,无明显现象,根据以上事实,判断三种金属的活动性强弱,正确的是( )| A. | X>Y>Z | B. | Y>Z>X | C. | Y>X>Z | D. | Z>Y>X |
分析 在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序.
解答 解:现有X、Y、Z三种金属,位于氢前面的金属能置换出酸中的氢,且金属的活动性越强,与酸反应的速率越快,把X、Y分别放入稀盐酸中,Y产生气体的速率比X快,说明Y的金属活动性比X强,即Y>X.
把Z放入硫酸铜溶液中,一段时间后,无明显现象,说明Z的金属活动性比铜弱,即Cu>Z.
铜排氢的后面,则三种金属的活动性强弱顺序为Y>X>Z.
故选:C.
点评 本题难度不大,考查了金属活动性顺序的应用,掌握金属活动性顺序并能灵活运用是正确解答此类题的关键所在.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
16.乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人对该气味极其敏感,下列有关乙硫醇的说法不正确的是( )
| A. | 乙硫醇的相对分子质量为62 | |
| B. | 乙硫醇中C、H、S三种元素的质量比是2:6:1 | |
| C. | 硫元素的质量分数是$\frac{32}{12×2+1×6+32}$×100% | |
| D. | 在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏 |
14. 要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:
要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:
【查阅资料】①碳酸亚铁(FeCO3)具有还原性,在空气中灼烧生成的氧化物和CO2气体.
②FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水.
③FeCl2能使高锰酸钾溶液褪色,而FeCl3不能;FeCl3溶液中滴加KSCN溶液,溶液变红色,FeCl2溶液中滴加KSCN溶液,溶液不出现红色.
【猜想与假设】猜想1:固体成分是氧化铁;
猜想2:固体成分是四氧化三铁;
猜想3:固体成分是氧化铁和四氧化三铁.
【活动与探究】连接仪器、装好药品如图所示(加热和固定装置已省略),打开止水夹K,通入氧气,加热玻璃管X.当Y瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却.
取玻璃管里的少量固体于试管中,滴加盐酸,微热,固体完全溶解.将所得溶液分成甲、乙两份进行实验.
【结论与反思】(1)由上述实验现象可知,FeCO3在氧气中高温灼烧得到的固体产物是氧化铁,因此,猜想1(填“1”或“2”或“3”)是正确的.
(2)FeCO3在氧气中高温灼烧的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(3)上述实验a(填“a”或“b”)是多余的,因为无论是哪种猜想中的固体,溶于盐酸后溶液中都存在Fe3+,加入KSCN溶液后都会变红色,因此实验a不能判断固体的成分.
【总结与提升】(1)若实验结束时观察到Y瓶中仍然是澄清的,可能的原因是澄清石灰水的量不足,导致生成的碳酸钙转变成了可溶于水的碳酸氢钙.碳酸氢钙的化学式为Ca(HCO3)2.
(2)CO2使澄清石灰水变浑浊的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(3)华雪同学经过反思,觉得该实验设计还存在问题,因为如果在实验b中观察到高锰酸钾溶液褪色,就不能确定哪个猜想是正确的.所以华雪同学又对该实验进行了定量探究:取11.6g纯净的碳酸亚铁固体,在空气中高温灼烧至恒重,称得固体质量净减3.6g.通过计算即可确定:FeCO3和氧气充分反应后的固体成分是氧化铁.
 要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:
要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:【查阅资料】①碳酸亚铁(FeCO3)具有还原性,在空气中灼烧生成的氧化物和CO2气体.
②FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水.
③FeCl2能使高锰酸钾溶液褪色,而FeCl3不能;FeCl3溶液中滴加KSCN溶液,溶液变红色,FeCl2溶液中滴加KSCN溶液,溶液不出现红色.
【猜想与假设】猜想1:固体成分是氧化铁;
猜想2:固体成分是四氧化三铁;
猜想3:固体成分是氧化铁和四氧化三铁.
【活动与探究】连接仪器、装好药品如图所示(加热和固定装置已省略),打开止水夹K,通入氧气,加热玻璃管X.当Y瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却.
取玻璃管里的少量固体于试管中,滴加盐酸,微热,固体完全溶解.将所得溶液分成甲、乙两份进行实验.
| 实验编号 | 实验步骤 | 实验现象 |
| a | 向甲溶液中滴加KSCN溶液 | 溶液变红色 |
| b | 向乙溶液中滴加高锰酸钾溶液 | 高锰酸钾溶液的紫红色不消失 |
(2)FeCO3在氧气中高温灼烧的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(3)上述实验a(填“a”或“b”)是多余的,因为无论是哪种猜想中的固体,溶于盐酸后溶液中都存在Fe3+,加入KSCN溶液后都会变红色,因此实验a不能判断固体的成分.
【总结与提升】(1)若实验结束时观察到Y瓶中仍然是澄清的,可能的原因是澄清石灰水的量不足,导致生成的碳酸钙转变成了可溶于水的碳酸氢钙.碳酸氢钙的化学式为Ca(HCO3)2.
(2)CO2使澄清石灰水变浑浊的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O.
(3)华雪同学经过反思,觉得该实验设计还存在问题,因为如果在实验b中观察到高锰酸钾溶液褪色,就不能确定哪个猜想是正确的.所以华雪同学又对该实验进行了定量探究:取11.6g纯净的碳酸亚铁固体,在空气中高温灼烧至恒重,称得固体质量净减3.6g.通过计算即可确定:FeCO3和氧气充分反应后的固体成分是氧化铁.
1.下列做法符合环境保护要求的是( )
| A. | 回收废旧金属 | B. | 大量使用一次性塑料制品 | ||
| C. | 随意排放工业废水和生活污水 | D. | 实验室废物不经处理随意丢弃 |
18.下列实验操作中,正确的是( )
| A. |  加热液体 | B. |  稀释浓硫酸 | C. |  量取液体 | D. |  过滤 |
18. 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
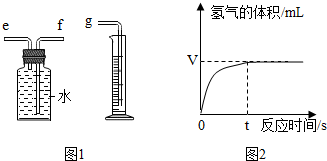
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
①若要检验上述实验收集到的气体是否为氧气,方法是将带火星的木条伸入集气瓶中,若带火星的木条复燃,则证明是氧气.
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.
 化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.
化学兴趣小组对“影响过氧化氢分解反应速率的因素--过氧化氢的质量分数和二氧化锰的用量”进行如下的实验探究,请你参与.【进行实验】
在室温下,选用10mL不同溶质质量分数的过氧化氢溶液(5%和10%)分别与0.2g、0.8g和1.0g的二氧化锰粉末进行实验.
(1)过氧化氢分解反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)用如图1所示装置收集并测量氧气的体积,其中量筒的作用是根据进入量筒中水的体积,判断生成氧气的体积,氧气应从e(选填e或f)管通入,再与g相连.
【数据处理】
(3)实验小组进行实验后,获得的相关实验数据如表所示:
| 实验编号 | 过氧化氢的质量分数 (均取10mL) | 二氧化锰粉末 的质量 | 氧气的体积(mL) (均收集5秒钟) |
| a | 5% | 0.2g | 65.8 |
| b | 5% | 0.8g | 85.7 |
| c | 5% | 1.0g | 85.7 |
| d | 10% | 0.2g | 121.9 |
| e | 10% | 0.8g | 171.5 |
| f | 10% | 1.0g | 171.5 |
②要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号是ad(写一组).由此可以得出的结论是:在催化剂、温度相同的条件下,过氧化氢的质量分数越大,反应速度越快.
③从上述实验中得出二氧化锰的用量对反应速率影响的结论是:在过氧化氢溶液的质量分数、温度相同的条件下,在一定的范围内,MnO2的用量越大,反应越快.
【拓展延伸】
(4)如图2是兴趣小组在记录生成氧气气体体积与对应时间的曲线,从曲线可以看出反应的速率逐渐变小,其原因是随着反应过氧化氢的质量分数变小,反应速度变慢.
(5)你认为影响过氧化氢分解反应速率的因素还有催化剂种类,请设计实验方案验证你的猜想取浓度相同、质量相同的过氧化氢溶液分别加入不同种类的同质量的催化剂进行实验,测定收集150mL氧气所需的时间即可.