题目内容
7.做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生.小伟提醒:是不是拿错了药品?我查验后确认药品没错,只是在瓶口发现有白色粉末状物质.我认为是氢氧化钠溶液变质了.(1)氢氧化钠溶液变质的原因是CO2+2NaOH═Na2CO3+H2O.
(2)利用与上述实验不同的方法,我又设计了一个实验再次确认该氢氧化钠溶液已变质.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氢氧化钠溶液于试管中,滴加稀盐酸 | 有气泡产生 | 该氢氧化钠溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加入足量的BaCl2溶液,静置在上层清液滴加几滴无色酚酞试液 | 白色沉淀,液体变红 | 该氢氧化钠溶液部分已变质 |
分析 (1)根据氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,写出反应的化学方程式即可.
(2)根据氢氧化钠和碳酸钠的性质不同可以选择合适的物质来进行鉴别,例如稀盐酸和氢氧化钠反应没有明显现象,但是可以和碳酸钠反应生成气体,可以据此解答.
(3)如果氢氧化钠全部变质则溶液为碳酸钠溶液,若部分变质则溶液为氢氧化钠与碳酸钠的混合溶液;因此,需要选用氯化钡等溶液除去溶液中的碳酸钠后,使用无色酚酞检验是否存在氢氧化钠,以确定是全部变质还是部分变质,可以据此解答该题.
解答 解:(1)氢氧化钠与空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O;
(2)根据氢氧化钠和碳酸钠的性质不同可以选择合适的物质来进行鉴别,例如稀盐酸和氢氧化钠反应没有明显现象,但是可以和碳酸钠反应生成气体.
(3)如果氢氧化钠全部变质则溶液为碳酸钠溶液,若部分变质则溶液为氢氧化钠与碳酸钠的混合溶液;因此,取少量样品于试管中,加入足量的BaCl2溶液,静置在上层清液滴加几滴无色酚酞试液,若观察到产生白色沉淀,而滴加酚酞后溶液变为红色,则说明氢氧化钠部分变质,其中碳酸钠和氯化钡反应的化学方程式为:Na2CO3+BaCl2═2NaCl+BaCO3↓.
故答案为:CO2+2NaOH═Na2CO3↓+H2O;
(2)
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氧氧化钠溶液于试管中,滴加 稀盐酸 | 有气泡产生;(其他合理答案皆可) | 该氢氧化钠 溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品于试管中,加入足量的BaCl2溶液,静置在上层清液滴加几滴无色酚酞试液 | 白色沉淀,液体变红 | 该氢氧化钠 溶液部分变质 |
点评 熟练掌握碳酸钠和氢氧化钠的性质,并会鉴别区分它们,在区分时由于碳酸钠溶液呈碱性能使无色酚酞变红,所以在检验氢氧化钠与碳酸钠混合溶液中的氢氧化钠时,可先用氯化钙或氯化钡等把碳酸钠除去,再滴加酚酞的方法进行检验.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
15.已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品.下列有关说法正确的是( )
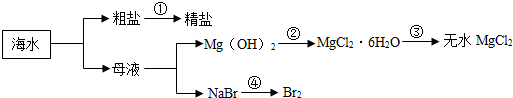
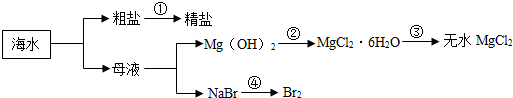
| A. | 第①步中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序为:NaOH溶液、Na2CO3溶液、BaCl2溶液,过滤后加盐酸 | |
| B. | 第②步中加入的试剂为CaCl2溶液 | |
| C. | 第③步中发生氧化还原反应 | |
| D. | 在第④步中溴元素被还氧化 |
12.为区别氢氧化钠和碳酸钠两种无色溶液,某同学设计了以下两种实验方案:
方案1:分别取少许两种溶液,各滴入几滴酚酞试液,根据是否变红色判断各是哪种溶液.
方案2:分别取少许两种溶液,各加入少量稀盐酸,根据是否有气泡产生判断各是哪种溶液.
请回答:
①该同学设计的两个方案中方案2是正确的;另一个方案不正确的原因是碳酸钠溶液也显碱性.
②请你用不同物质类别再设计一个实验,区别上述两种溶液:
方案1:分别取少许两种溶液,各滴入几滴酚酞试液,根据是否变红色判断各是哪种溶液.
方案2:分别取少许两种溶液,各加入少量稀盐酸,根据是否有气泡产生判断各是哪种溶液.
请回答:
①该同学设计的两个方案中方案2是正确的;另一个方案不正确的原因是碳酸钠溶液也显碱性.
②请你用不同物质类别再设计一个实验,区别上述两种溶液:
| 实验操作 | 实验现象 | 实验结论 |
| 取两只试管各取少量待测液,分别滴加稀盐酸 | 一支试管中有气泡生成 另一支试管中无现象 | 无色溶液是碳酸钠溶液 |
17. 在2003年春我国非典型肺炎流行期间,许多地方都用过氧乙酸作消毒剂.过氧乙酸的分子结构如图所示.下列有关过氧乙酸的叙述不正确的是( )
在2003年春我国非典型肺炎流行期间,许多地方都用过氧乙酸作消毒剂.过氧乙酸的分子结构如图所示.下列有关过氧乙酸的叙述不正确的是( )
 在2003年春我国非典型肺炎流行期间,许多地方都用过氧乙酸作消毒剂.过氧乙酸的分子结构如图所示.下列有关过氧乙酸的叙述不正确的是( )
在2003年春我国非典型肺炎流行期间,许多地方都用过氧乙酸作消毒剂.过氧乙酸的分子结构如图所示.下列有关过氧乙酸的叙述不正确的是( )| A. | 化学式为C2H4O3 | B. | 相对分子质量为76 | ||
| C. | 完全燃烧生成CO2和H2O | D. | C、H、O三种元素的质量比为3:1:4 |
