题目内容
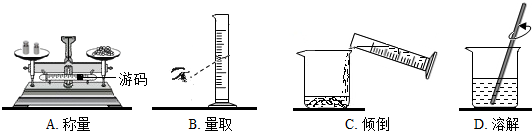
5.从事科学实验的重要环节是进行科学实验设计,科学实验的正确步骤为::①明确实验目的②收集有关资料③设计合理方案④进行科学实验.请你按照以上四步,完成以下实验设计,根据装置图回答问题:(所用装置图用序号表示)
(1)实验室制取氧气、二氧化碳的发生装置是B,它们反应的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)氧气的收集方法是C或E,若收到较纯净的氧气,制备与收集装置是BE;
(3)二氧化碳的收集方法是C,检验二氧化碳通过澄清石灰水,写出该反应的化学方程式Ca(OH)2+CO2═CaCO3↓+H2O;
(4)在实验室中常用加热固体氯化铵和氢氧化钙的方法制取氨气,其反应的文字表达式为:氯化铵+氢氧化钙$\stackrel{加热}{→}$氯化钙+水+氨气.已知在标准状况下,氨气的密度为0.771克/L,空气的密度为1.293克/L,且在常温常压下,1体积的水能溶解700体积的氨气.
①所用的发生装置是A;
②收集氨气的方法是D.
分析 通常情况下,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气;
氧气的密度比空气的密度大,不易溶于水;
实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
二氧化碳能够溶于水,密度比空气大,能使澄清石灰水变浑浊;
根据制取气体的反应物状态、反应条件、气体的性质可以选择发生装置和收集装置.
解答 解:(1)实验室利用过氧化氢和二氧化锰制取氧气不需要加热,利用大理石或石灰石和稀盐酸制取二氧化碳不需要加热,因此发生装置应该用B装置;
利用过氧化氢和二氧化锰、大理石或石灰石和稀盐酸制取氧气、二氧化碳反应的化学方程式是:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,CaCO3+2HCl═CaCl2+H2O+CO2↑.
故填:B;2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)因为氧气的密度比空气大,可以用向上排空气法收集,即用C装置收集,氧气不易溶于水,可以用排水法收集,即用E装置收集,用排水法收集的氧气比用排空气法收集的氧气纯净.
故填:C或E;BE.
(3)二氧化碳能够溶于水,不能用排水法收集,密度比空气大,可以用向上排空气法收集,即用C装置收集;
检验二氧化碳通过澄清石灰水,二氧化碳能使澄清的石灰水变浑浊,是因为二氧化碳和石灰水中的氢氧化钙反应生成了碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
故填:C;澄清石灰水;Ca(OH)2+CO2═CaCO3↓+H2O.
(4)①因为用固体氯化铵和氢氧化钙制取氨气需要加热,所用的发生装置是A;
②氨气极易溶于水,不能用排水法收集,密度比空气小,可以用向下排空气法收集,即用D装置收集.
故填:A;D.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 氧化作用 | B. | 作反应物 | C. | 作催化剂 | D. | 提供热量 |
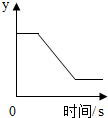 一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,如图所示,纵坐标(y)表示的是( )
一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,如图所示,纵坐标(y)表示的是( )| A. | 生成O2的质量 | B. | 固体中MnO2的质量 | ||
| C. | 固体中氧元素的质量 | D. | 固体中钾元素的质量分数 |
| A. | 硫在空气中燃烧--蓝紫色火焰 | |
| B. | 铁丝在氧气中燃烧--剧烈燃烧,火星四射,生成黑色固体 | |
| C. | 木炭在空气中燃烧--生成有刺激性气味的气体 | |
| D. | 红磷在空气中燃烧--产生大量白雾 |
| A. | Cu | B. | Fe | C. | S | D. | 木炭 |
| A. |  向一定量的二氧化锰中加入过氧化氢溶液 向一定量的二氧化锰中加入过氧化氢溶液 | |
| B. |  用酒精灯加热一定量KMnO4固体 用酒精灯加热一定量KMnO4固体 | |
| C. |  将水通电一段时间 将水通电一段时间 | |
| D. |  在某一密闭装置内点燃红磷 在某一密闭装置内点燃红磷 |