题目内容
8.某化学兴趣小组对水蒸气通过灼热的焦炭后,得到的混合气体主要成分产生了兴趣.同学们决定通过实验进行探究.【提出猜想】该混合气体成分为:一氧化碳、二氧化碳、氢气和水蒸气.
【查阅资料】
a.无水硫酸铜遇水由白色变为蓝色;
b.碱石灰是固体氢氧化钠和氧化钙的混合物;
c.H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
d.CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
【实验过程】
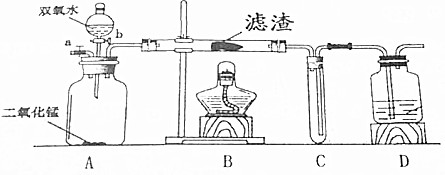
同学们在老师的指导下设计了如图1所示装置,并进行了实验(部分夹持仪器已略去).
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论混合气体中含有水蒸气和二氧化碳.
(2)装置D中的药品为浓硫酸.
(3)同学们通过观察装置E、F中的现象后,证明了混合气中含有氢气.为了证明第四种气体的存在,可用装有澄清石灰水(填试剂名称)的装置G.
【实验结论】猜想正确.
【实验反思】
经过讨论,同学们将图1中装置C~H进行了简化,改进后的装置如图2所示:
其中,干燥管中碱石灰的作用为除去混合气体中剩余的CO2和水蒸气,烧杯上能观察到的现象是烧杯内壁有水雾产生,进一步证明第四种气体的存在实验操作是将烧杯倒过来,倒入少量澄清石灰水,振荡.

分析 (1)根据无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊,判断混合气体中的气体;
(2)CD装置应是除去(1)中所验证的气体;
(3)根据E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,判断混合气体中其余气体;
【实验反思】根据碱石灰是固体氢氧化钠和氧化钙的混合物做出判断;根据剩余的氢气和一氧化碳可以燃烧判断烧杯中的现象和最后一步实验操作.
解答 解:(1)由无水硫酸铜遇水变蓝和澄清石灰水遇二氧化碳变浑浊的特点可知,混合气体中有水蒸气和二氧化碳;
故答案为:混合气体中有水蒸气和二氧化碳;
(2)C装置中应是浓氢氧化钠,目的是吸收混合气体中的二氧化碳,D装置中应是浓硫酸,目的是吸收混合气体中的水蒸气.故答案为:浓硫酸;
(3)E中氧化铜变红,说明有一氧化碳气体或氢气或二者的混合气体;F中无水硫酸铜变蓝,说明有氢气,因为氢气还原氧化铜可生成水;G中澄清石灰水变浑浊,说明有一氧化碳气体,因为一氧化碳还原氧化铜可生成二氧化碳;同时E中的变化说明,一氧化碳具有还原性.
【实验反思】碱石灰是固体氢氧化钠和氧化钙的混合物,其中的氢氧化钠固体可吸收二氧化碳,氧化钙可吸收水蒸气.在尖嘴处点燃气体,在火焰上方罩一个干燥、洁净的烧杯,若烧杯壁上有小水珠(或水雾),则证明有氢气,因氢气燃烧生成水;将烧杯倒过来,倒入少量澄清石灰水,振荡,石灰水变浑浊.说明有一氧化碳.因一氧化碳燃烧生成了二氧化碳.
故答案为:(1)混合气体中含有水蒸气和二氧化碳;
(2)浓硫酸;
(3)澄清石灰水;
实验反思:(3)除去混合气体中剩余的CO2和水蒸气
(4)烧杯内壁有水雾产生; 将烧杯倒过来,倒入少量澄清石灰水,振荡.
点评 本题以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,同学们要具有综合的化学知识才能做好此题.

| A. | 食盐 | B. | 食醋 | C. | 蔗糖 | D. | 芝麻油 |

 面粉加工厂的车间里若悬浮着较多的面粉粉尘,遇明火就有发生爆炸的危险.下面是模拟粉尘爆炸的一个实验:
面粉加工厂的车间里若悬浮着较多的面粉粉尘,遇明火就有发生爆炸的危险.下面是模拟粉尘爆炸的一个实验: