题目内容
17.量取40ml酒精,应选用的仪器是( )| A. | 10 ml的量筒 | B. | 100 ml的量筒 | ||
| C. | 50 ml的量筒和胶头滴管 | D. | 500 ml的量筒和胶头滴管 |
分析 量筒量液时要注意量程的选择,应选择略大于量取液体体积的量程,选取的量程太大,会因刻度不精确而使量取的液体体积不准确,选取的量程太小,多次称量会有误差
解答 解:用量筒量取40mL液体,应选择略大于40mL的量程.
故选C.
点评 本题主要考查量筒中量程的选择方法.

练习册系列答案
相关题目
10.如图所示,王欢同学操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
8.某实验小组利用废硫酸液制备K2SO4
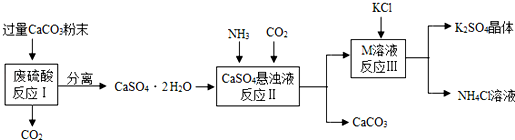
(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是防止硫酸钾流失;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入b(选填序号,下同),振荡、静置,再向上层清液中滴加a,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.

(1)将CaCO3研成粉末的目的是与硫酸充分反应.
(2)上述流程中可循环使用的物质有CO2和CaCO3(填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是常温下硫酸钾的溶解度远小于氯化铵的溶解度.
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液.
12.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.
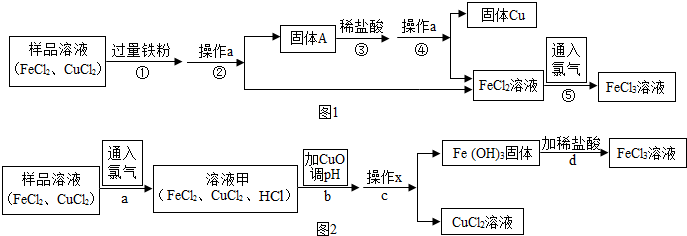
实验一:(如图1)
(1)写出步骤①中发生的化学方程式Fe+CuCl2═FeCl2+Cu,此反应的基本类型是置换反应.
(2)步骤②中的操作a名称是过滤;步骤③中加入稀盐酸的目的是除去过量的铁粉.
实验二:该实验小组同学通过查阅资料,又进行了另一种尝试.
【阅读资料】不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
(3)如图2,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式CuO+2HCl=CuCl2+H2O;你认为步骤b调节溶液的pH到3.2~4.7(数值范围)比较合适.
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.

实验一:(如图1)
(1)写出步骤①中发生的化学方程式Fe+CuCl2═FeCl2+Cu,此反应的基本类型是置换反应.
(2)步骤②中的操作a名称是过滤;步骤③中加入稀盐酸的目的是除去过量的铁粉.
实验二:该实验小组同学通过查阅资料,又进行了另一种尝试.
【阅读资料】不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.
如表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
9.下列说法错误的是( )
| A. | 离子是带电的原子或原子团 | |
| B. | 水分子是由两个氢元素和一个氧元素构成的 | |
| C. | 分子、原子和离子都是构成物质的微粒 | |
| D. | 原子的质量主要集中在原子核上 |

 分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
分别表示N2、H2、NH3.观察如图,写出符合在催化剂表面合成氨反应过程的顺序⑤④①②③(将如图五张图按反应过程顺序用序号排列).
 如图是电解水实验的示意图:
如图是电解水实验的示意图: