题目内容
13.化学是研究物质的组成、结构、性质及变化规律的科学.(1)在干冰、金刚石、氯化钠三种物质中,由离子构成的是氯化钠.
(2)下列符号能表示2个分子的是②(填序号).①2O ②2O2 ③Mg2+ ④SO42-
(3)在高温条件下,A、B两种物质发生反应生成C和D.反应前后分子种类变化的微观示意图如图所示.

①一个A分子中共含有5个原子.
②A、B、C、D 四种物质中,属于氧化物的是BC,可作燃料的是ACD.
③B中氢元素与氧元素的质量比为1:8.
④在该反应中,生成C和D的质量比为14:3.
分析 (1)构成物质的基本微粒有分子、原子和离子,金属单质都是由原子构成的,盐类物质由离子构成,干冰是由分子构成的;
(2)根据标在元素符号前面的数字表示原子的个数;标在化学式前面的数字表示分子的个数;标在元素符号右下角的数字表示一个分子中所含原子的个数;根据标在离子符号前面的数字表示离子个数;进行解答.
(3)①根据A分子的微观构成判断一个A分子中共含有原子的数目.
②根据物质的微观构成,判断物质的类别及物质的性质.
③根据B物质的构成写出化学式,计算氢元素与氧元素的质量比;根据A的微观构成,写出化学式计算氢元素的质量分数.
④根据微观示意图,写出反应的方程式来分析解答;
解答 解:(1)构成物质的基本微粒有分子、原子和离子,干冰是由二氧化碳分子构成的,金刚石是由碳原子构成的,氯化钠是由钠离子、氯离子构成,
(2)根据标在化学式前面的数字表示分子的个数;所以②2O2 表示2个氧分子;故②符合题意;
(3)①由A的微观构成可知,一个A分子中共含有5个原子.
②由四种物质的微观构成可知,A是甲烷、B是水、C是一氧化碳、D是氢气;故BC是氧化物;A是甲烷、C是一氧化碳、D是氢气,都具有可燃性.
(3)由B的微观构成可知,B是水,水中氢元素与氧元素的质量比为:(1×2):16=1:8,
(4)由变化的微观示意图可知,该反应是甲烷和水在高温条件下反应生成了一氧化碳和氢气,反应的方程式是:CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2.故C和D的质量比为:(12+16):3×1×2=14:3;
故答案:
(1)氯化钠; (2)②;(3)①5; ②BC; ACD;③1:8 ④14:3(或28:6).
点评 本题考查了常见物质的微观构成、以及微粒的性质,完成此题,可以依据已有的知识进行解答.

| A. |  | B. |  | C. |  | D. |  |
| A. | CO(NH2)2 | B. | KCl | C. | Ca(H2PO4)2 | D. | KOH |
| A. | K+、NO3-、OH- | B. | H+、Na+、HCO3- | C. | H+、SO42-、OH- | D. | NH4+、NO3-、OH- |
(1)从海水中提取金属镁,可按图1流程进行:
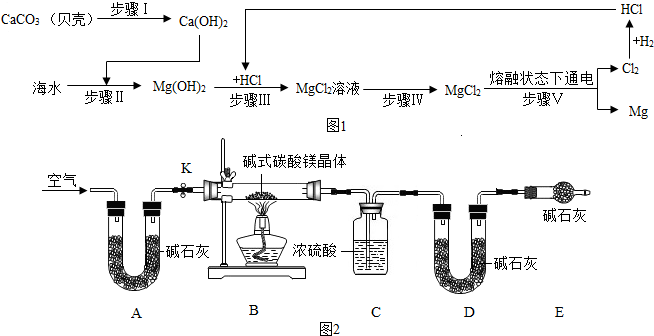
①下列说法正确的是B(填字母).
A.步骤Ⅰ通过一步反应即可实现 B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能 D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应.
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究.
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3•yMg(OH)2•zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物.
【设计实验】该小组同学设计了图2所示的实验装置,假设每步反应和吸收均进行完全.
| 装置C的质量 | 装置D的质量 | |
| 步骤③ | 292.4g | 198.2g |
| 步骤⑥ | 296.9g | 207.0g |
①连接好装置并检查气密性.
②装入药品,打开活塞K,通入一段时间空气.③分别称量装置C、D的质量(数据见右表).
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解.
⑤停止加热,同时打开活塞K,通入空气至恢复到室温.
⑥再次分别称量装置C、D的质量(数据见表).
【实验分析】
①装置A的作用为除去空气中的二氧化碳和水,装置D的作用为吸收反应生成的二氧化碳.
②反应后,装置B中的剩余固体是MgO(或氧化镁),质量为10g.
③该碱式碳酸镁晶体[xMgCO3•yMg(OH)2•zH2O]中,x:y:z=4:1:4(写最简整数比).
| A. | 氢氧化钙溶液 | B. | 浓盐酸 | C. | 氢氧化钠溶液 | D. | 浓硫酸 |

