题目内容
1. 某不纯的铁粉与稀硫酸反应时质量关系如图所示.X表示在反应中不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )
某不纯的铁粉与稀硫酸反应时质量关系如图所示.X表示在反应中不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )| A. | Mg | B. | Zn | C. | Cu | D. | Ag |
分析 根据铁与硫酸反应的化学方程式可以计算出5.6g纯铁能生成0.2g氢气,由于5g<5.6g,说明不纯的铁中所含的杂质能与盐酸反应且能产生氢气,而且产生等质量的氢气需要该金属的质量小于5g进行分析.
解答 解:由图象可知5g金属反应最终生成氢气的质量是0.2g;
假设样品为纯铁,需要铁的质量是x,
Fe+H2SO4 ═FeSO4+H2↑
56 2
x 0.2g
$\frac{56}{x}$=$\frac{2}{0.2g}$
x=5.6g>5g,
因此产生等质量的氢气需要另一种金属的质量小于5g,银、铜不能反应,
假设样品为纯锌,需要锌的质量是y,
Zn+H2SO4 ═ZnSO4+H2↑
65 2
y 0.2g
$\frac{65}{y}$=$\frac{2}{0.2g}$
x=6.5g>5g,不符合题意,
假设样品为纯镁,需要镁的质量是z,
Mg+H2SO4 ═MgSO4+H2↑
24 2
z 0.2g
$\frac{24}{z}$=$\frac{2}{0.2g}$
x=2.4g<5g,符合题意,
故选:A.
点评 本题的关键是所含杂质:能与盐酸反应、能产生氢气、与铁的质量相等时比铁产生的氢气多.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
8.有一种石灰石样品,其中含有的杂质是二氧化硅.某学生想测定该样品的纯度,他取用2克这种石灰石样品,把20克稀盐酸分4次加入,充分反应后剩余固体的质量见下表.
问:
(1)2克石灰石样品中,有杂质多少克?
(2)石灰石样品的纯度是多少?
(3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
| 稀盐酸的用量 | 第1次加入5克 | 第2次加入5克 | 第3次加入5克 | 第4次加入5克 |
| 剩余固体的质量 | 1.315克 | 0.63克 | 0.3克 | 0.3克 |
(1)2克石灰石样品中,有杂质多少克?
(2)石灰石样品的纯度是多少?
(3)100千克这种纯度的石灰石充分煅烧后,可得到固体多少千克?
9.下列属于复合材料的是( )
| A. | 塑料 | B. | 合成纤维 | C. | 陶瓷 | D. | 钢筋混凝土 |
16.按要求填空:
(1)填表:
(2)酒精从血液传入肝脏,在肝脏中被氧化成二氧化碳和水,释放出能量,试写出这个过程的化学变化表达式:C2H5OH+3O2$\frac{\underline{\;酶\;}}{\;}$2CO2+3H2O
(3)成人的肝脏每小时只能承受10mL酒精.如果某人的血液中经常有大量的酒精存在,则他的肝脏受损或肝硬化;工业不能饮用,因为其中含有有毒的甲醇.
(4)一天晚上,甲、乙、丙、丁四人一起喝酒,下面是每人喝酒的情况:
甲:3杯葡萄酒、1杯北京二锅头;
乙:1杯葡萄酒、3杯橙汁;
丙:5杯啤酒、1杯葡萄酒;
丁:2杯啤酒、1杯北京二锅头.
如果从交通安全考虑将对驾驶员的法定量标准定为50mL,则什么人不能开车回家?
答:丙.
(1)填表:
| 酒 | 含酒精的体积分数(%) | 测量1杯酒的体积(mL) | 计算1杯酒中酒精的体积(mL) |
| 啤 酒 | 4 | 1杯啤 酒:250mL | |
| 葡萄酒 | 10 | 1杯葡萄酒:100mL | |
| 北京二锅头 | 60 | 1杯白酒:20mL |
(3)成人的肝脏每小时只能承受10mL酒精.如果某人的血液中经常有大量的酒精存在,则他的肝脏受损或肝硬化;工业不能饮用,因为其中含有有毒的甲醇.
(4)一天晚上,甲、乙、丙、丁四人一起喝酒,下面是每人喝酒的情况:
甲:3杯葡萄酒、1杯北京二锅头;
乙:1杯葡萄酒、3杯橙汁;
丙:5杯啤酒、1杯葡萄酒;
丁:2杯啤酒、1杯北京二锅头.
如果从交通安全考虑将对驾驶员的法定量标准定为50mL,则什么人不能开车回家?
答:丙.
13.下列变化过程,只发生物理变化的是( )
| A. | 食物腐败 | B. | 干冰升华 | C. | 面粉爆炸 | D. | 镁带燃烧 |
10.下列实验方案一定能达到实验目的是( )
| 选项 | 实验目的 | 实验方法 |
| A | 鉴别纯铝和硬铝 | 取样,加入少量硫酸铜溶液 |
| B | 除去二氧化碳中的一氧化碳 | 将气体点燃 |
| C | 检验硝酸钠溶液中是否有氯化钠 | 取样,滴加少量硝酸溶液 |
| D | 探究电解水后生成的气体 | 用带火星的木条检验电源负极端的气体 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |

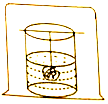 如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).
如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).