题目内容
3.FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验.实验小组同学通过查阅资料,进行了尝试.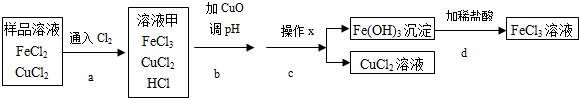
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离.右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
| Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀的pH | 1.9 | 4.7 |
| 沉淀完全的pH | 3.2 | 6.7 |
(2)实验中,步骤d加稀盐酸前,因缺少洗涤(填操作名称)而使获得的氯化铁溶液不纯.
(3)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用C(用字母表示)最合理.
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
分析 (1)氧化铜和稀盐酸反应生成氯化铜和水;
根据表中提供的信息可以判断步骤b调节溶液的pH范围;
(2)氢氧化铁沉淀上面附着有杂质,通过洗涤可以除去杂质;
(3)氯化铁中含有氯离子,稀盐酸中含有氯离子,稀硝酸中含有硝酸根离子,稀硫酸中含有硫酸根离子,稀醋酸中含有醋酸根离子.
解答 解:(1)盐酸与氧化铜反应的化学方程式为:CuO+2HCl═CuCl2+H2O;
步骤b调节溶液的pH到3.2~4.7时,氢氧化铁能够完全析出,同时氢氧化铜不能析出.
故填:CuO+2HCl═CuCl2+H2O;3.2~4.7.
(2)实验中,步骤d加稀盐酸前,因缺少洗涤而使获得的氯化铁溶液不纯.
故填:洗涤.
(3)加入稀硝酸会带入硝酸根离子,加入稀硫酸会带入硫酸根离子,加入稀醋酸会带入醋酸根离子,为了防止FeCl3溶液变质,加入稀盐酸最合理.
故填:C.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
相关题目
12.下列物质中存在氢分子的是( )
| A. | 水 | B. | 硫酸 | C. | 液态氢 | D. | 过氧化氢 |

 按图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: