题目内容
2.如图四个图象中能正确反应其对应实验操作的是( )| A. |  向氢氧化钠溶液中加水 | |
| B. | 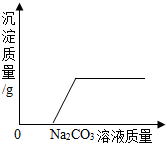 向一定量的氯化钙和盐酸的混合溶液中不断加入碳酸钠溶液 | |
| C. |  水的电解 | |
| D. | 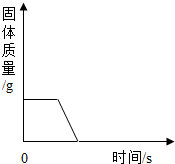 加热碱式碳酸铜 |
分析 A、根据氢氧化钠溶液中加水稀释溶液的pH变化进行解答;
B、根据盐酸和氯化钙混合溶液中不断滴入碳酸钠时先是盐酸与碳酸钠的反应,不会产生沉淀,盐酸耗尽氯化钙与碳酸钠反应会生成碳酸钙的沉淀,直至反应结束进行解答;
C、根据电解水的实验中生成氢气和氧气质量关系进行解答;
D、根据加热碱式碳酸铜后生成氧化铜、水和二氧化碳进行解答.
解答 A、氢氧化钠溶液中加水稀释,溶液的pH会变小,但不会小于7,故A错误;
B、盐酸和氯化钙混合溶液中不断滴入碳酸钠时先是盐酸与碳酸钠的反应,不会产生沉淀,此时沉淀为零,盐酸耗尽氯化钙与碳酸钠反应会生成碳酸钙的沉淀,直至反映结束图象形成一条水平线,故B正确;
C、电解水的实验中生成氢气和氧气的质量比为1:8,而不是2:1,故C错误;
D、加热碱式碳酸铜后生成氧化铜、水和二氧化碳,则固体的质量不断减少,直到反应完毕,但质量不会为0,故D错误.
故选:B.
点评 此题是化学反应与图象知识的考查题,结合反应的过程与图象情况的走势联系起来是解题的关键所在.

练习册系列答案
相关题目
12.下列叙述中,不正确的是( )
| A. | 过氧化氢分解反应是破坏旧分子、形成新分子的变化 | |
| B. | 复分解反应的实质是参加反应的物质间离子的互换 | |
| C. | 空气中PM2.5含量高说明空气质量好 | |
| D. | 化学变化的过程常会伴随能量变化 |
14.如表列出了除去物质中所含少量杂质的方法,其中错误的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO | CO2 | 通过足量氢氧化钠溶液,干燥 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| D | 氧化钙 | 碳酸钙 | 加水溶解,过滤 |
| A. | A | B. | B | C. | C | D. | D |
11.下列说法正确的是( )
| A. | K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 | |
| B. | 化合物是含有不同元素的纯净物,所以含有不同种元素的纯净物一定是化合物 | |
| C. | NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 | |
| D. | 金、银、铜金属活动性顺序逐渐减弱 |

 以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
以下是甲、乙两同学对有关镁与盐酸反应的系列研究.