题目内容
某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
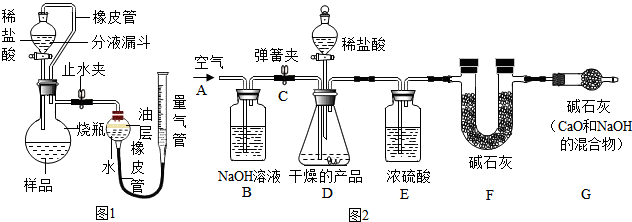
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.右图为大理石与稀盐酸反应的反应装置,并测量CO2的体积.(其他仪器省略)
(1)图1中左侧的橡皮管的作用 .
(2)图1中装置中油层的作用是 .
(3) (填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积.
乙组同学:
【查阅资料】
1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分取样品,研成粉状后,按如图2进行实验.
(1)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次快速通一段时间空气;⑥称量F的质量,计算前后两次质量差.最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:①产品研成粉状的目的 ;
②B装置的作用是 ;
G装置的作用是 .
③若没有E装置,则测定的CaCO3的质量分数会 (填“偏大 偏小 不变”).
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的 .
【总结反思】:
(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因 .
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因 .
甲组同学:

测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.右图为大理石与稀盐酸反应的反应装置,并测量CO2的体积.(其他仪器省略)
(1)图1中左侧的橡皮管的作用
(2)图1中装置中油层的作用是
(3)
乙组同学:
【查阅资料】
1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分取样品,研成粉状后,按如图2进行实验.
(1)实验步骤:
①连接好装置,检查气密性; ②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量; ④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次快速通一段时间空气;⑥称量F的质量,计算前后两次质量差.最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:①产品研成粉状的目的
②B装置的作用是
G装置的作用是
③若没有E装置,则测定的CaCO3的质量分数会
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的
【总结反思】:
(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,盐的化学性质
专题:科学探究
分析:利用氢氧化钠、氢氧化钙等碱性物质能与空气中的二氧化碳发生化学反应生成碳酸盐,而导致化学试剂失效,因此检验方法可以从如何检验碳酸根离子出发,对于测定生成二氧化碳的质量或体积,可以将碳酸根离子与酸反应生成二氧化碳,再通过测定体积的装置测出体积或通过吸收剂吸收计算出质量;
甲组同学:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量;
乙组同学:利用碱石灰可以吸收二氧化碳气体和水分取样品,根据实验步骤,进行实验探究.
甲组同学:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量;
乙组同学:利用碱石灰可以吸收二氧化碳气体和水分取样品,根据实验步骤,进行实验探究.
解答:解:甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量,图中为大理石与稀盐酸反应的反应装置,并测量CO2的体积;
(1)图中左侧的橡皮管的作用是:使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差;
(2)图中装置中油层的作用是:隔绝CO2和水,防止CO2溶于水并和水反应;
(3)反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积;
乙组同学:(2)问题探究:①产品研成粉的目的是:增大与盐酸的接触面积加快反应速率,使反应进行的更充分;
②B装置的作用是:吸收除去空气中的二氧化碳,使装置中的CO2全部被碱石灰吸收,以免对实验干扰;
G装置的作用是:防止空气中二氧化碳和水份进入F中以免对实验干扰;
③若没有E装置,气体中存在水分,则F中碱石灰的质量偏大,则测定的CaCO3的质量分数会偏大;
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是:排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰;
【总结反思】(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因是:二氧化碳溶于水中;
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因是:步骤⑤中快速通空气使空气中二氧化碳没有吸收完全.
故答案为:甲组同学(1)使分液漏斗和烧瓶内的气压始终保持平衡;
(2)防止CO2溶于水;
(3)反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平;
乙组同学(2)①增大与盐酸的接触面积加快反应速率,使反应进行的更充分;
②吸收除去空气中的二氧化碳,以免对实验干扰;
防止空气中二氧化碳和水份进入F中以免对实验干扰;
③偏大;
④排除装置内空气中二氧化碳气体,以免对实验干扰;
【总结反思】(1)二氧化碳溶于水中;
(2)步骤⑤中快速通空气使空气中二氧化碳没有吸收完全.
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量,图中为大理石与稀盐酸反应的反应装置,并测量CO2的体积;
(1)图中左侧的橡皮管的作用是:使分液漏斗和烧瓶内的气压始终保持平衡防止测得气体体积有误差;
(2)图中装置中油层的作用是:隔绝CO2和水,防止CO2溶于水并和水反应;
(3)反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积;
乙组同学:(2)问题探究:①产品研成粉的目的是:增大与盐酸的接触面积加快反应速率,使反应进行的更充分;
②B装置的作用是:吸收除去空气中的二氧化碳,使装置中的CO2全部被碱石灰吸收,以免对实验干扰;
G装置的作用是:防止空气中二氧化碳和水份进入F中以免对实验干扰;
③若没有E装置,气体中存在水分,则F中碱石灰的质量偏大,则测定的CaCO3的质量分数会偏大;
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是:排除装置内空气中二氧化碳气体,使装置中的CO2全部被碱石灰吸收,以免对实验干扰;
【总结反思】(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因是:二氧化碳溶于水中;
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因是:步骤⑤中快速通空气使空气中二氧化碳没有吸收完全.
故答案为:甲组同学(1)使分液漏斗和烧瓶内的气压始终保持平衡;
(2)防止CO2溶于水;
(3)反应结束冷却,关闭止水夹,调节量气管高度,使反应前后两边液面相平;
乙组同学(2)①增大与盐酸的接触面积加快反应速率,使反应进行的更充分;
②吸收除去空气中的二氧化碳,以免对实验干扰;
防止空气中二氧化碳和水份进入F中以免对实验干扰;
③偏大;
④排除装置内空气中二氧化碳气体,以免对实验干扰;
【总结反思】(1)二氧化碳溶于水中;
(2)步骤⑤中快速通空气使空气中二氧化碳没有吸收完全.
点评:本题综合考查了氢氧化钠的性质以及碳酸根的检验方法及其计算,计算时要注意步骤的规范性.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
现有40g质量分数为10%的NaCl溶液,要使其溶质质量分数达到20%,可采用的方法是( )
①蒸发20g水. ②蒸发24g水 ③加入3.2g NaCl ④加入5g NaCl.
①蒸发20g水. ②蒸发24g水 ③加入3.2g NaCl ④加入5g NaCl.
| A、只有① | B、①③ | C、①④ | D、②③ |
下列过程中发生化学变化的是( )


| A、②④ | B、①④ | C、②③ | D、只有① |

 2014年APEC峰会于11月10-11日在北京举行,为了使被雾霾困扰多日的北京重现蓝天,附近多个省、市实行了城区内机动车单双号限行.如图是雾霾笼罩下的北京城.
2014年APEC峰会于11月10-11日在北京举行,为了使被雾霾困扰多日的北京重现蓝天,附近多个省、市实行了城区内机动车单双号限行.如图是雾霾笼罩下的北京城.