题目内容
11. 甲、乙、丙、丁初中化学常见的物质,如图是四种物质间的转化关系图,部分反应条件略去.
甲、乙、丙、丁初中化学常见的物质,如图是四种物质间的转化关系图,部分反应条件略去.(1)若甲为红棕色物质,是赤铁矿的主要成分,则甲的化学式Fe2O3,则乙物质不可能是:B.(填序号)
A.酸 B.碱 C.氧化物 D.单质
请写出工业上以赤铁矿为原料炼铁的化学方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(2)若甲和丁为单质,乙、丙为化合物,该反应属于置换反应,请写出符合要求化学方程式Fe+CuSO4=FeSO4+Cu.(任写符合要求的一个反应即可).
(3)若甲、乙、丙、丁均是化合物,甲与丙属于同一类型的物质,甲是常用的改良酸性土壤的碱,则甲的俗名是熟石灰,则该转化的化学方程式可能是Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)若甲为天然气的主要成分,甲的名称是甲烷,该物质完全燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
分析 根据已有的物质的星盒子进行分析解答,甲是铁矿石的主要成分,则甲是氧化铁,氧化铁能与一氧化碳高温反应生成铁和二氧化碳;根据置换反应的概念解答;甲能用于改良酸性土壤,则甲是熟石灰氢氧化钙;天然气的主要成分是甲烷,据此解答.
解答 解:(1)甲为红棕色物质,是赤铁矿的主要成分,则甲是氧化铁,氧化铁能与酸反应、能与一氧化碳反应,能与碳或氢气单质反应,故乙不可能是碱,故填:Fe2O3,B,Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(2)甲和丁为单质,乙、丙为化合物,该反应属于置换反应,可以是铁与硫酸铜溶液的反应,故填:置换,Fe+CuSO4=FeSO4+Cu;
(3)甲、乙、丙、丁均是化合物,甲与丙属于同一类型的物质,甲是常用的改良酸性土壤的碱,则甲是氢氧化钙,丙可以是氢氧化钠,可以是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:熟石灰,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)甲为天然气的主要成分,则甲是甲烷,甲烷完全燃烧生成二氧化碳和水,故填:甲烷,CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
点评 本题考查的是常见的物质的推断,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
相关题目
19.“节能减排,低碳生活”的主题旨在倡导节约能源和利用清洁能源,减少温室气体二氧化碳的排放.下列措施中不符合该主题的是( )
| A. | 回收利用废旧金属 | B. | 推广使用一次性塑料制品 | ||
| C. | 广泛使用太阳能等清洁能源 | D. | 短途出行多乘坐公交车或骑自行车 |
6.饮料中的果味大多来自酯类.丁酸乙酯(C6H12O2)是无色具有菠萝香味的液体,常用作食品、饮料的调香剂.有关叙述中正确的是( )
| A. | 丁酸乙酯是由20个原子构成的 | |
| B. | 丁酸乙酯的相对分子质量为116 | |
| C. | 丁酸乙酯中碳元素质量分数为27.6% | |
| D. | 丁酸乙酯中碳、氢、氧的质量比为6:12:2 |
16.茶叶中含有的茶氨酸(C7H14O3N2)可以降低血压、提高记忆力、保护神经细胞等.下列有关茶氨酸的说法中,正确的是( )
| A. | 茶氨酸属于有机高分子化合物 | |
| B. | 茶氨酸中碳元素与氢元素的质量比为1:2 | |
| C. | 茶氨酸中碳元素的质量分数最大 | |
| D. | 一个茶氨酸分子中含有一个氮分子和一个臭氧分子 |
3.下列图象与对应的叙述相符合的是( )
| A. | 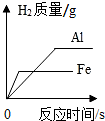 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应 | |
| B. |  向H2SO4和MgSO4的混合溶液中滴加NaOH溶液 | |
| C. | 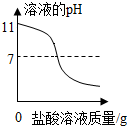 向pH=11的NaOH溶液中不断加稀盐酸 | |
| D. | 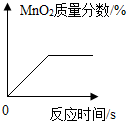 加热KClO3和MnO2的混合物 |
1.将60g镁、铁、铝的混合物放入到一定质量的稀硫酸中恰好完全反应,收集到氢气4g,将反应后的溶液蒸干可得硫酸盐的质量是( )
| A. | 202g | B. | 256g | C. | 252g | D. | 不能确定 |

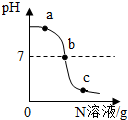 已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.