题目内容
2.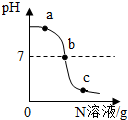 已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.(1)N是稀盐酸,b点表示的意义是盐酸与氢氧化钠恰好反应反应的化学方程式为HCl+NaOH═NaCl+H2O,所属基本反应类型是复分解反应.
(2)据图分析c处溶液中的阳离子有Na+、H+(填写离子符号).
分析 (1)由溶液的酸碱度与酸碱性之间的关系分析判断M溶液和N溶液,再写出反应的方程式;
(2)c处溶液pH小于7,溶液显酸性.
解答 解:(1)氢氧化钠溶液呈碱性,其pH大于7,盐酸溶液呈酸性,其pH小于7,由图象可以看出,开始时溶液的pH大于7,可以确定是向氢氧化钠溶液中滴加盐酸,反应的方程式是:NaOH+HCl=NaCl+H2O;属于复分解反应,氢氧化钠溶液和盐酸溶液发生中和反应生成氯化钠和水,恰好完全反应时其pH等于7.
(2)c处溶液pH小于7,溶液显酸性,可知加入的酸是过量的,能把氢氧化钠全部反应掉,而且还有剩余,溶液中的溶质有氯化钠和盐酸,电离的离子有Na+、H+、Cl-.
故答案:(1)稀盐酸 盐酸与氢氧化钠恰好反应.(其它合理也可)
HCl+NaOH═NaCl+H2O 复分解 (2)Na+、H+
点评 本体主要考查了中和反应及反应后溶液成分的探究,解题时,根据实验的反应原理,利用所取的样品进行实验的现象,分析推断出中和反应的溶液中物质的组成成分.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.通过下列实验操作和现象能得出相应结论的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向收集满CO2的软塑料瓶中加入约$\frac{1}{3}$体积的H2O溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与H2O反应 |
| B | 50℃时,将17gKCl固体加入50g蒸馏水中,完全溶解后缓慢降温 | 降温至20℃时开始有晶体析出 | 20℃时,KCl的溶解度为17g |
| C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
| D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生 | 该气体是H2 |
| A. | A | B. | B | C. | C | D. | D |
17.在一定温度下,向一定量的饱和食盐水中加入少量的食盐,则此饱和溶液的质量将( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
7.对二甲苯(简称PX,化学式为C8H10)是一种无色透明液体,具有芳香气味,作为一种重要的化工原料,在我国化工产业发展中占有重要地位.下列对于对二甲苯的说法正确的是( )
| A. | 对二甲苯由18个原子构成 | |
| B. | 对二甲苯分子由碳元素和氢元素组成 | |
| C. | 对二甲苯的相对分子质量为106 | |
| D. | 对二甲苯中碳、氢元素质量比为4:5 |
 甲、乙、丙、丁初中化学常见的物质,如图是四种物质间的转化关系图,部分反应条件略去.
甲、乙、丙、丁初中化学常见的物质,如图是四种物质间的转化关系图,部分反应条件略去. 金属及其制品是现代生活中常见的材料,请回答下列问题:
金属及其制品是现代生活中常见的材料,请回答下列问题: