题目内容
2.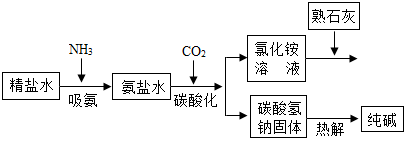 利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德榜先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:
利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德榜先生发明的,其氯化钠的利用率高达96%.其原理流程如图所示:(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水).氨盐水比食盐水更容易吸收二氧化碳,其原因是氨盐水显碱性;
(2)写出氯化铵溶液与熟石灰反应的化学方程式:2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
分析 (1)根据氨水显碱性,有利于吸收二氧化碳气体
(2)氯化铵溶液与熟石灰反应生成氯化钙、水和氨气,写出反应的化学方程式即可.
解答 解:(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水),氨盐水显碱性,氨盐水比食盐水更容易吸收二氧化碳.
(2)氯化铵溶液与熟石灰反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
故答案为:(1)氨盐水显碱性;(2)2NH4Cl+Ca(OH)2═CaCl2+2H2O+2NH3↑.
点评 本题难度不大,理解生产纯碱的“联合制碱法”流程图,掌握盐的化学性质、化学方程式的书写方法等是正确解答本题的关键.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
12.在贝壳上滴稀盐酸,能产生使澄清石灰水浑浊的气体,则贝壳中含有的离子是( )
| A. | CO32- | B. | SO42- | C. | Ca2+ | D. | OH- |
7.下列各组离子在水溶液中能大量共存的是( )
| A. | Na +、Cl -、H +、CO 3 2- | B. | Ag +、Ca 2+、NO 3-、Cl- | ||
| C. | NO 3-、OH -、Cu 2+、Na + | D. | K +、Mg 2+、Cl -、NO3- |
 电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题:
电蚊拍一般使用2.4V镍氢电池,工作时电网瞬间产生1850V直流高压电(电流小于10mA,对人畜无害),能将蚊虫吸入电网电毙.如图是一款电蚊拍,请根据图示回答下列问题:
 某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算:
某工厂排放的废水中含有NaOH和Na2CO3,为了测定废水中NaOH的质量分数,取废水100g逐滴加入稀盐酸至过量,测得生成气体的质量与所加稀盐酸的质量关系如图所示.试计算: 使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.
使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放.