题目内容
10.计算在标准状况下100升空气中氧气和氮气的质量各是多少克?(在标准状况下,氧气的密度为1.429克/升,氮气的密度为1.25克/升)分析 解答本题根据空气的总体积,由氧气和氮气的体积分数算出氧气和氮气的体积;再根据质量与密度、体积之间的关系来计算.
解答 解:因为氧气在空气中的体积分数为21%,所以氧气体积为21L;氮气在空气中的体积分数为78%,所以氮气体积为78L,所以,氧气的质量=21L×1.429g/L=30g,氮气的质量=78L×1.25/L=97.5g,
答:在标准状况下100升空气中氧气和氮气的质量分别是30g和97.5g.
点评 本题考查了空气中氧气和氮气的体积分数及体积、质量之间的计算,属于基础性的考查.

练习册系列答案
相关题目
10.如图是硝酸钾和氯化钠两种固体物质的溶解度曲线,下列叙述错误的是( )

| A. | t1℃时,向分别盛有3.6g NaCl和KMO3固体的烧杯中各加入10g水,充分搅拌后两种固体能全部溶解 | |
| B. | t2℃时,NaCl和KMO3两种物质的饱和溶液都降温至t1℃,两种溶液中溶质的质量分数相等 | |
| C. | t2℃时,将100g KMO3饱和溶液降温到t1℃,会有44g晶体析出 | |
| D. | KMO3中含有少量NaCl,可以用冷却热饱和溶液的方法提纯KMO3 |
15.关于相对原子质量,下列叙述正确的是( )
| A. | 相对原子质量就是原子质量 | |
| B. | 两种原子的质量之比等于它们的相对原子质量之比 | |
| C. | 所有碳原子的质量都相同 | |
| D. | 相对原子质量约等于原子核内质子质量和中子质量之和 |
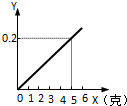 某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )
某不纯的铁粉与稀硫酸反应时,质量关系如图所示,x表示不纯铁粉消耗的质量,Y表示生成氢气的质量,试判断不纯铁粉中混入的杂质是( )

 有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.
有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题.