题目内容
14.水煤气是将水蒸气通过灼热的焦炭而生成的气体,主要成分是一氧化碳、氢气及少量的二氧化碳和水蒸气.设计如下实验装置来验证水煤气的成分.请回答下列问题: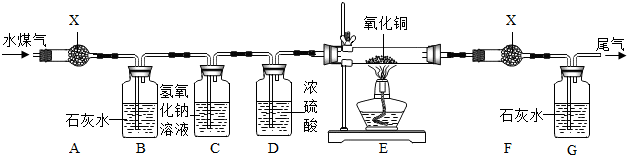
(1)该实验中验证水煤气中各成分的先后顺序是(填化学式)H2O CO2 H2 CO.
(2)装置C、D的目的分别是吸收CO2,干燥气体.
(3)证明混合气体中有CO的现象是氧化铜由黑变亮红,G中石灰水变浑浊.
(4)试剂X是CuSO4.
(5)请你设计一种尾气处理方案尾气出口处安放一个点燃的酒精灯,将其燃烧掉或收集.
(6)B装置中反应的化学方程式为Ca(OH)2+CO2═CaCO3↓+H2O.
分析 (1)根据水能使白色硫酸铜变蓝,二氧化碳能使澄清石灰水变浑浊,氢气还原氧化铜能生成水,一氧化碳还原氧化铜生成二氧化碳考虑本题;
(2)根据氢氧化钠能与二氧化碳反应考虑,浓硫酸具有吸水性解答;
(3)根据氧化铜被还原成铜考虑实验现象解答;
(4)根据无水硫酸铜和水反应变蓝色考虑本题;
(5)根据一氧化碳有毒,会污染环境,应进行尾气处理;
(6)根据二氧化碳和石灰水反应写出反应的方程式.
解答 解:(1)水能使白色硫酸铜变蓝,先通过无水硫酸铜是检验是否含有水的;二氧化碳能使澄清石灰水变浑浊,再通过石灰水是检验是否含有二氧化碳的;再通过氢氧化钠是除去原来的二氧化碳气体,通过浓硫酸是除去原来的水蒸气,通过氧化铜是检验是否含有还原性气体,再通过无水硫酸铜,是看是否有水生成,因为氢气还原氧化铜生成铜和水,所以是为了检验是否有氢气的;最后通过澄清石灰水是看有没有二氧化碳生成,由于一氧化碳还原氧化铜生成铜和二氧化碳,所以是为了检验是否含有一氧化碳的;
(2)前面的装置A是为了检验是否有水生成,后面的装置A是为了检验是否有水生成,从而确定是否有氢气存在.由于氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,装置C可吸收二氧化碳;浓硫酸具有吸水性,则装置D的作用是:除去水蒸气;
(3)在加热的条件下,一氧化碳和氢气能将氧化铜还原为铜,则装置E内观察到的现象是:黑色粉末变成红色;二氧化碳能够使石灰水变浑浊;
(4)水能使白色硫酸铜变蓝,因此X中是硫酸铜能够检验是否含有氢气反应产生的水,从而证明氢气的存在;
(5)一氧化碳有毒,直接排放到空气中会污染环境,可将玻璃管改成尖嘴点燃或用气球收集;
(6)二氧化碳能够和氢氧化钙反应产生碳酸钙沉淀和水,反应的方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
故答案为:(1)H2O CO2 H2 CO.
(2)吸收CO2,干燥气体.
(3)氧化铜由黑变亮红,G中石灰水变浑浊.
(4)CuSO4.
(5)尾气出口处安放一个点燃的酒精灯,将其燃烧掉或收集.
(6)Ca(OH)2+CO2═CaCO3↓+H2O.
点评 本题难度不是很大,以实验探究的形式考查常见气体氢气、一氧化碳、二氧化碳和水蒸气的性质,熟练掌握常见气体的化学性质并能灵活运用是正确解答本题的关键.

| A. | 氧气可用于医疗急救 | B. | 空气的主要成分是氮气和氧气 | ||
| C. | 新鲜空气中不含二氧化碳 | D. | 食品包装袋中充入氮气以防腐 |
| a | b | c | d | |
| b | 无明显现象 | 有气体生成 | 有沉淀生成 | |
| c | 有气体生成 | 有气体生成 | 有沉淀生成 |
| A. | H2SO4、Na2CO3、BaCl2、HCl | B. | BaCl2、Na2CO3、HCl、H2SO4 | ||
| C. | H2SO4、HCl、Na2CO3、BaCl2 | D. | HCl、H2SO4、Na2CO3、BaCl2 |
| A. | 人和动物的呼吸 | B. | 焚烧塑料垃圾 | C. | 工厂的废气 | D. | 汽车排放的尾气 |
| A. | 掩耳盗铃 | B. | 死灰复燃 | C. | 刻舟求剑 | D. | 冰雪消融 |

