题目内容
3.某兴趣小组利用如图1装置探究制取气体原理、方法及性质.结合装置图,回答问题:
(1)如果采用A、E装置的组合,用高锰酸钾制取氧气,反应方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;实验时应在试管口放一团棉花,根据燃烧的条件分析,棉花没有燃烧的原因是温度没有得到着火点.
(2)实验室常用AC装置的组合制取二氧化碳气体(填字母),该反应的化学方程式是CaCO3+2HCl=CaCl2+H2O+CO2↑;为了得到纯净、干燥的二氧化碳气体,除杂装置(如图2所示)的导管气流方向连接顺序是B(填字母).
A、a→b→c→d B、c→d→a→b C、b→a→c→d D、d→c→b→a.
(3)常用澄清石灰水检验二氧化碳的存在,该反应的化学方程式为CO2+Ca(OH)2═CaCO3↓+H2O;若二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙[Ca(HCO3)2],该反应的化学方程式为CaCO3+H2O+CO2═Ca(HCO3)2.
分析 (1)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,写出反应的化学方程式即可;燃烧需要同时满足三个条件:①可燃物、②氧气或空气、③温度要达到着火点,进行分析解答.
(2)根据实验室中制取二氧化碳的反应原理和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择收集装置.
(3)根据二氧化碳与石灰水反应生成碳酸钙沉淀和水,二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙[Ca(HCO3)2],进行分析解答.
解答 解:(1)高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,反应的化学方程式是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
实验时应在试管口放一团棉花,棉花没有燃烧,因为温度没有得到着火点.
(2)实验室中制取二氧化碳常用大理石或石灰石和稀盐酸反应来制取,属于固液常温型,同时生成氯化钙、水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.所以应该选择A装置来制取二氧化碳气体;二氧化碳密度比空气大,能溶于水,所以应该选择C装置来收集二氧化碳.
要得到纯净干燥的二氧化碳应该先除杂再干燥,即先通过饱和的碳酸氢钠溶液吸收氯化氢杂质,再通过浓硫酸除去水,导气管的连接顺序是“长进短出”,故连接顺序是:c→d→a→b.
(3)二氧化碳与石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
若二氧化碳过量,二氧化碳又会与碳酸钙、水反应生成易溶的碳酸氢钙[Ca(HCO3)2],该反应的化学方程式为CaCO3+H2O+CO2═Ca(HCO3)2.
故答案为:(1)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;温度没有得到着火点;
(2)AC;CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)B;CO2+Ca(OH)2═CaCO3↓+H2O;CaCO3+H2O+CO2═Ca(HCO3)2.
点评 本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取气体的反应原理、发生装置和收集装置的选择依据等是正确解答本题的关键.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案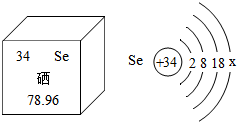 硒是人体生命活动中必需的微量元素之一,是人体内的抗氧化剂,能提高人体免疫力,具有多种生物功能,硒被誉为“抗癌大王”.如图提供了硒的有关信息,下列说法中,正确的是( )
硒是人体生命活动中必需的微量元素之一,是人体内的抗氧化剂,能提高人体免疫力,具有多种生物功能,硒被誉为“抗癌大王”.如图提供了硒的有关信息,下列说法中,正确的是( )| A. | 硒的相对原子质量是78.96,硒属于金属元素 | |
| B. | 硒原子序数和原子核内中子数均为34 | |
| C. | 硒原子和硫原子化学性质相似,其Se2-的核外电子数为36 | |
| D. | 硒元素对人体有那么多的好处,其补充多多益善 |
| A. | 食物腐烂 | B. | 菜刀生锈 | C. | 天然气燃烧 | D. | 水放进冰箱结冰 |
| A. | C2O3能使澄清石灰水变浑浊 | B. | C2O3的密度比空气的密度大 | ||
| C. | C2O3在一定条件下能还原氧化铁 | D. | C2O3在O2中充分燃烧的产物为CO2 |
| A. | 陶瓷、橡胶、水银、碳都是很好的绝缘材料 | |
| B. | 金、银、铜等都是很好的导体 | |
| C. | 铝、碳、铁、玻璃都是很好的磁性材料 | |
| D. | 超导体是一种电阻很大的材料 |
| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | 水蒸发 | B. | 用活性炭除去冰箱中的异味 | ||
| C. | 节日燃放烟花 | D. | 自行车胎充气过多爆炸 |
| A. | 海水晒盐 | B. | 风力发电 | ||
| C. | 太阳能取暖 | D. | 煅烧石灰石制生石灰 |