题目内容
11. 现有一瓶未开封的浓硫酸,部分标签如图所示,根据这些数据回答下列问题.
现有一瓶未开封的浓硫酸,部分标签如图所示,根据这些数据回答下列问题.(1)取该浓硫酸10g配制成质量分数为9.8%的稀硫酸需要加水多少克?
(2)向一定量的氢氧化钠溶液中加入100g上述配制的稀硫酸,恰好完全反应,则参加反应的氢氧化钠的质量是多少?(提示:2NaOH+H2SO4═Na2SO4+2H2O)
分析 (1)根据稀释前后溶液中溶质的质量不变来进行解答;
(2)根据反应的化学方程式结合硫酸的质量解答即可.
解答 解:(1)设需加水的质量为x,根据溶液稀释前后溶质的质量相等可得:
10g×98%=(x+10g)×9.8%,解得:x=90g
(2)设参加反应的氢氧化钠的质量为y.
2NaOH+H2SO4═Na2SO4+2H2O
80 98
y 100g×9.8%=9.8g
则$\frac{80}{98}=\frac{y}{9.8g}$,解得:y=8g
答:(1)取该浓硫酸10g配制成质量分数为9.8%的稀硫酸需要加水90克;
(2)参加反应的氢氧化钠的质量是8g.
点评 该题充分的体现了用化学的知识去解决生活中的问题,要求学生要熟练的掌握溶液的稀释及有关溶液中溶质质量分数的计算问题.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
6.在含钙元素8g的CaCl2和CaCO3的混合物中加入100g某浓度的稀盐酸,恰好完全反应,产生4.4gCO2,试求反应后所得溶液的溶质的质量分数为多少( )
| A. | 4% | B. | 11.14% | C. | 19.0% | D. | 15.2% |
3.实验室需要一瓶大约有$\frac{1}{4}$空气的氧气,下列收集装置中,你认为该采用的是( )
| A. |  集气瓶中装$\frac{1}{4}$的水 | B. |  集气瓶中装$\frac{3}{4}$的水 | ||
| C. |  导管伸入到集气瓶体积的$\frac{1}{4}$处 | D. |  导管伸入到集气瓶体积的$\frac{3}{4}$处 |
 化学是在原子、分子水平上研究物质及其变化的科学.
化学是在原子、分子水平上研究物质及其变化的科学.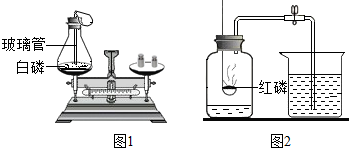 如图进行试验,请按要求填空.
如图进行试验,请按要求填空.