题目内容
20.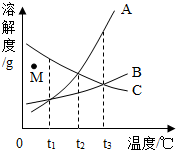 如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图所示,下列说法正确的是( )
如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图所示,下列说法正确的是( )| A. | t2℃时,溶解度最大的物质是A | |
| B. | 若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是降低温度 | |
| C. | t2℃时,将等质量的A、B、C的饱和溶液都升温到t3℃,溶液中溶剂质量的大小关系是(忽略水的挥发)B>A=C | |
| D. | t1℃时,将A、B、C三种固体物质分别溶于水所得溶液的溶质质量分数C>A=B |
分析 根据题目信息和溶解度曲线可知:A、B两种固体物质的溶解度,都是随温度升高而增大,而C的溶解度随温度的升高而减少;t2℃时,溶解度最大的物质是A和C;若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是降低温度错误,应该是升高温度,因为C的溶解度随温度的升高而减少;t2℃时,将等质量的A、B、C的饱和溶液都升温到t3℃,溶液中溶剂质量的大小关系是(忽略水的挥发)B>A=C正确,因为B的溶解度在t2℃时最小,水最多;t1℃时,将A、B、C三种固体物质分别溶于水所得溶液的溶质质量分数C>A=B错误,因为没有指明是饱和溶液.
解答 解:A、t2℃时,溶解度最大的物质是A和C,故选项错误;
B、若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是降低温度错误,应该是升高温度,因为C的溶解度随温度的升高而减少;故选项错误;
C、t2℃时,将等质量的A、B、C的饱和溶液都升温到t3℃,溶液中溶剂质量的大小关系是(忽略水的挥发)B>A=C正确,因为B的溶解度在t2℃时最小,水最多;故选项正确;
D、t1℃时,将A、B、C三种固体物质分别溶于水所得溶液的溶质质量分数C>A=B错误,因为没有指明是饱和溶液;故选项错误;
故选C
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关饱和溶液与不饱和溶液的相互转化等,本考点主要出现在选择题和填空题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列现象的产生,与空气中的水蒸气无关的是( )
| A. | 酥脆的饼干放置在空气中变软 | |
| B. | 夏天从冰柜中拿出矿泉水,一会儿瓶壁上出现水珠 | |
| C. | 云雨的形成 | |
| D. | 石灰水敞口放置于空气中变质 |
15.学习了有关金属的性质,同学们对影响化学反应速率的因素进行探究.
(1)发现和提出问题:
①镁在空气中就能够剧烈燃烧,铁丝在氧气中才能够剧烈燃烧,此现象说明镁比铁活泼,化学反应的速率与金属本身的性质有关.
②夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率.温度如何影响反应速率呢?
(2)猜想与假设:其它条件相同时,温度越高,反应速率越快.
(3)收集证据
取10mL稀硫酸,均分为两等份,分别放入试管中,各加入大小相同的锌粒,再分别放入盛有20℃和80℃水的烧杯中,塞紧带有气球的瓶塞,观察现象.
(1)发现和提出问题:
①镁在空气中就能够剧烈燃烧,铁丝在氧气中才能够剧烈燃烧,此现象说明镁比铁活泼,化学反应的速率与金属本身的性质有关.
②夏天,将食品放在冰箱里不容易变质,这一事例说明温度也能影响化学反应速率.温度如何影响反应速率呢?
(2)猜想与假设:其它条件相同时,温度越高,反应速率越快.
(3)收集证据
取10mL稀硫酸,均分为两等份,分别放入试管中,各加入大小相同的锌粒,再分别放入盛有20℃和80℃水的烧杯中,塞紧带有气球的瓶塞,观察现象.
| 实验步骤 | 实验现象 | 实验结论 |
 | a、b中均有气泡产生,b中产生气泡的速度比a快(或b中气球膨胀的速度比a快) | 其它条件下相同时,温度越高,反应速率越快.反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑ |
5.金属材料在生产、生活中广泛应用,有许多性质等内容需要探究.
(1)下表提供了在一定条件下,水能否与一些金属发生反应的信息.
①请根据金属活动性顺序和表中的已知信息,将表格填写完整.
②虽然铁在常温下与水不反应,但铁制品在潮湿的环境中很容易生锈.某同学进行了如图1所示实验.一周以后发现铁钉表面锈蚀.在图中a、b、c三处,锈蚀情况最严重的是b(填字母).

(2)镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
【查阅资料】①常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应;
②浓硫酸具有吸水性.
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关.
【进行实验】通过控制与镁条接触的物质,利用图2装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天.
【解释与结论】
①实验1和2中,NaOH浓溶液的作用是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示).
②实验1的目的是检验只用氧气是否会使镁条变黑.
③实验3中,试管内的气体主要含有CO2、氧气、氮气.
④得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是2、5(填编号).
⑤由上述实验可推知,镁条变黑的条件是水、二氧化碳、氧气.
【反思与评价】
⑥在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是常温下氮气的化学性质不活泼,很难与其它物质反应.
⑦欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需试剂是稀盐酸和澄清的石灰水.
(1)下表提供了在一定条件下,水能否与一些金属发生反应的信息.
①请根据金属活动性顺序和表中的已知信息,将表格填写完整.
| 物质 | 钠与冷水 | 镁与冷水 | 镁与水蒸汽 | 铁与冷水 | 铁与水蒸气 |
| 能否发生反应 | 剧烈反应 | 缓慢反应 | 剧烈反应 | 不反应 | 加热条件下能反应 |

(2)镁条在空气中久置表面会变黑,某小组同学设计并进行实验,探究镁条变黑的条件.
【查阅资料】①常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应;
②浓硫酸具有吸水性.
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关.
【进行实验】通过控制与镁条接触的物质,利用图2装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天.
| 编号 | 主要实验操作 | 实验现象 |
| 1 | 先充满用NaOH浓溶液洗涤过的空气; 再加入2mL浓硫酸 | 镁条始终无明显变化 |
| 2 | 加入2mLNaOH浓溶液 | 镁条始终无明显变化 |
| 3 | 先加入2mL浓硫酸; 再通入约4mLCO2 | 镁条始终无明显变化 |
| 4 | 先加入4mL饱和Na2SO3溶液; 再充满CO2 | 镁条始终无明显变化 |
| 5 | 先加入2mL蒸馏水; 再通入约4mLCO2 | 镁条第3天开始变黑, 至20天全部变黑 |
①实验1和2中,NaOH浓溶液的作用是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示).
②实验1的目的是检验只用氧气是否会使镁条变黑.
③实验3中,试管内的气体主要含有CO2、氧气、氮气.
④得出“镁条变黑一定与CO2有关”的结论,依据的两个实验是2、5(填编号).
⑤由上述实验可推知,镁条变黑的条件是水、二氧化碳、氧气.
【反思与评价】
⑥在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是常温下氮气的化学性质不活泼,很难与其它物质反应.
⑦欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需试剂是稀盐酸和澄清的石灰水.
12.下列安全图标中,表示“禁止烟火”的是( )
| A. |  | B. |  | C. |  | D. |  |
