题目内容
8.某碳酸钙和氧化钙组成的混合物中钙元素的质量分数为50%,将60g该混合物高温煅烧至固体质量不再改变,则生成二氧化碳的质量是( )| A. | 16g | B. | 18g | C. | 20g | D. | 22g |
分析 因为反应后减少的是二氧化碳,钙元素全部转化为CaO中的钙,则只要计算出所有CaO中的钙元素即可求出.
解答 解:60g混合物含钙元素的质量=60g×50%=30g,反应前混合物中钙元素的质量也为30g;高温煅烧生成氧化钙的质量:30g÷($\frac{40}{40+16}$×100%)=42g,故产生的二氧化碳质量:60g-42g=18g.
故选B.
点评 本题考查元素的质量分数计算,学生利用碳酸钙完全分解后固体为氧化钙,再利用钙元素的质量守恒来推断生成氧化钙的质量是解答的关键.

练习册系列答案
相关题目
18.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氯化钠 食盐 NaCl | B. | 碳酸氢钠 纯碱 NaHCO3 | ||
| C. | 氢氧化钙 熟石灰 CaO | D. | 氢氧化钠 火碱 KOH |
3.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案可行的是( )
| A. | 木炭粉(CuO)-在空气中灼烧 | |
| B. | KCl溶液(CaCl2)-通入过量的CO2气体,过滤 | |
| C. | NaOH溶液(Na2CO3)-加入适量的澄清石灰水,过滤 | |
| D. | H2(HCl气体)-依次通过足量的NaOH溶液和浓硫酸 |
18.如图所示实验操作中,正确的是( )
| A. |  | B. |  | C. |  | D. |  |

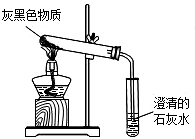 镁将成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源.
镁将成为21世纪重要的轻型环保材料,我国含有非常丰富的镁资源. 小组同学分别用如图所示装置(夹持仪器已略去)做收集并检验二氧化碳性质的实验,连接A、B装置时,应将A装置中的e连接B装置中的a(选填“a”或“c”),实验中.
小组同学分别用如图所示装置(夹持仪器已略去)做收集并检验二氧化碳性质的实验,连接A、B装置时,应将A装置中的e连接B装置中的a(选填“a”或“c”),实验中. 实验室用过量的稀盐酸和大理石制取CO2,取100g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.
实验室用过量的稀盐酸和大理石制取CO2,取100g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.