题目内容
2.将22.1gNaCl和FeCl3的固体混合体完全溶于58.6g水,加入30gNaOH溶液后,溶液恰好呈中性,滤出沉淀后,溶液的质量为100g.试计算:(1)产生沉淀的质量为10.7g;
(2)所得溶液中溶质的质量分数为多少?
分析 氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)产生沉淀的质量为:22.1g+58.6g+30g-100g=10.7g,
故填:10.7.
(2)设氯化铁质量为x,生成氯化钠质量为y,
FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
162.5 107 175.5
x 10.7g y
$\frac{162.5}{x}$=$\frac{107}{10.7g}$=$\frac{175.5}{y}$,
x=16.25g,y=17.55g,
所得溶液中溶质的质量分数为:$\frac{22.1g-16.25g+17.55g}{100g}$×100%=23.4%,
答:所得溶液中溶质的质量分数为23.4%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.

练习册系列答案
相关题目
13.我们身边有各种各样的物质,下列生活中的一些做法,主要利用了物质的化学性质的是( )
| A. | 用不锈钢制炊具 | B. | 用活性炭除去冰箱中的异味 | ||
| C. | 米酿成醋 | D. | 将西瓜放进榨汁机榨取西瓜汁 |
10.下列物质的名称、俗名与化学式完全对应的是( )
| A. | 氢氧化钙 熟石灰 CaO | B. | 汞 水银 Hg | ||
| C. | 碳酸氢钠 苏打 NaHCO3 | D. | 碳酸钠 烧碱 Na2CO3 |
17. 如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
 如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )| A. | t1℃时a、c两种物质的饱和溶液中溶质质量相等 | |
| B. | t2℃时,将50g a物质放入50g水中充分溶解后只能得到75g a的饱和溶液 | |
| C. | 将t1℃时a、b、c三种物质的饱和溶液升温至t2℃时,所得溶液的溶质质量分数关系是b>a>c | |
| D. | 将接近饱和的c溶液变为饱和溶液,可采用降低温度的方法 |
6. 如图装置所示,经数小时后,U形管A、B两处的液面将会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封)( )
如图装置所示,经数小时后,U形管A、B两处的液面将会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封)( )
 如图装置所示,经数小时后,U形管A、B两处的液面将会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封)( )
如图装置所示,经数小时后,U形管A、B两处的液面将会出现下列哪种情况(实验装置足以维持实验期间小白鼠的生命活动,瓶口密封)( )| A. | A处上升,B处下降 | B. | A、B两处都下降 | C. | A处下降,B处上升 | D. | A、B两处都不变 |
3.下列关于资源能源叙述错误的是( )
| A. | 煤、石油和天然气是化石燃料且不可再生,我们要节约能源 | |
| B. | 空气是一种宝贵的资源,它主要是由氧气和氮气组成的 | |
| C. | 氢能 源没有污染、燃烧放热多,来源广并且成本低,现已普及使用 | |
| D. | 使用乙醇汽油既节约石油资源、又能减少污染空气还能促进农业生产 |
4.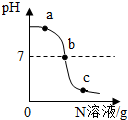 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某兴趣实验小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示:
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某兴趣实验小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示:
(1)M是氢氧化钠(填物质名称).
(2)反应过程中,老师取a、b、c三处反应后的溶液,打乱顺序后,请同学们不测定溶液的pH值,用其它方法对三种溶液进行探究.
小明和小红分别取其中一种溶液进行实验:
小明向所取溶液中加入硫酸铜溶液,观察到有蓝色沉淀生成.
结论:是a处溶液.
小红向少量另一种溶液中滴加酚酞溶液,观察到酚酞不变色,
结论:是b处或c处溶液.
为进一步确定该溶液成分,小红又设计并完成如下实验:
剩余一种为b处溶液,
通过实验,同学们知道了酸碱反应过程中pH的变化和用不同方法确定溶液成分
(3)兴趣实验小组同学通过实践调查,某工厂的废酸液污染了下水,上网获得如下信息,拟选用下列物质处理废水:
如果要求花最少的钱来反应同样量的废硫酸,则应选择NaOH(填物质化学式).
 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某兴趣实验小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示:
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某兴趣实验小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示:(1)M是氢氧化钠(填物质名称).
(2)反应过程中,老师取a、b、c三处反应后的溶液,打乱顺序后,请同学们不测定溶液的pH值,用其它方法对三种溶液进行探究.
小明和小红分别取其中一种溶液进行实验:
小明向所取溶液中加入硫酸铜溶液,观察到有蓝色沉淀生成.
结论:是a处溶液.
小红向少量另一种溶液中滴加酚酞溶液,观察到酚酞不变色,
结论:是b处或c处溶液.
为进一步确定该溶液成分,小红又设计并完成如下实验:
| 实验步骤 | 现象 | 结论 |
| 为c处溶液,并推知溶液中的 离子有Na+、H+、SO42-(填写离子符号) |
通过实验,同学们知道了酸碱反应过程中pH的变化和用不同方法确定溶液成分
(3)兴趣实验小组同学通过实践调查,某工厂的废酸液污染了下水,上网获得如下信息,拟选用下列物质处理废水:
| 物质 | 相对分子质量 | 市场参考价值(元/Kg) |
| CaCO3 | 100 | 1.8 |
| Ca(OH)2 | 74 | 2.0 |
| NaOH | 40 | 11.5 |

 A~F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去)
A~F是初中化学中常见的六种物质,其中B、C组成元素相同,C、D、E、F是不同类别的化合物,D和E的溶液均呈碱性,且E可用作建筑材料,它们相互间的关系如图所示,(图中“-”表示相连的物质两两之间可以发生反应,“→”表示由某一物质转化为另一物质,部分反应物、生成物及反应条件已略去)