题目内容
 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A、甲物质的溶解度比乙物质的溶解度大 |
| B、升温能使甲物质的不饱和溶液变为饱和溶液 |
| C、20℃时,两种物质的饱和溶液中溶质的质量分数相等 |
| D、30℃时,100g甲的饱和溶液中含有25g甲物质 |
考点:固体溶解度曲线及其作用,饱和溶液和不饱和溶液相互转变的方法,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:A、根据某一温度时物质溶解度的比较方法考虑;B、不饱和溶液变为饱和溶液的方法考虑;C、根据饱和溶液的质量分数=
×100%;D、根据30℃时,甲的溶解度考虑.
| 溶解度 |
| 100g+溶解度 |
解答:解:A、比较溶解度大小必须有温度的限制,否则不能比较溶解度大小,故A错;
B、由甲物质的溶解度随温度的升高而增大,所以升温后溶解度变大,不饱和溶液不可能变为饱和溶液,故B错;
C、饱和溶液的质量分数=
×100%;由于20℃时,两种物质的溶解度相等,所以20℃时,两种物质的饱和溶液中溶质的质量分数相等,故C正确;
D、30℃时,甲的溶解度是25g,即30℃时,100g水中最多溶解25g甲物质,故D错.
故选:C.
B、由甲物质的溶解度随温度的升高而增大,所以升温后溶解度变大,不饱和溶液不可能变为饱和溶液,故B错;
C、饱和溶液的质量分数=
| 溶解度 |
| 100g+溶解度 |
D、30℃时,甲的溶解度是25g,即30℃时,100g水中最多溶解25g甲物质,故D错.
故选:C.
点评:溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度;同一温度下,不同溶质的溶解度;温度对不同物质的溶解度影响不同.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
如图是钠元素、氧元素在周期表中的相关信息及有关粒子的结构示意图.下列说法错误的是( )


| A、钠元素的原子序数为11 |
| B、氧离子的结构示意图是D |
| C、AB两种元素组成的化合物的化学式可为Na2O |
| D、钠元素与氧元素的最本质的区别是最外层电子数不同 |
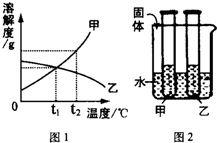 如图1是甲、乙两种固体物质的溶解曲线,如图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )
如图1是甲、乙两种固体物质的溶解曲线,如图2是盛水的烧杯中放着t2℃下甲、乙两种物质饱和溶液的试管(不考虑溶剂的蒸发),根据图象和有关信息判断,下列说法中错误的是( )| A、t2℃时,甲、乙两种物质的饱和溶液中溶质的质量分数大小关系为:甲>乙 |
| B、将甲、乙两种物质的饱和溶液都从t2℃降至将甲、乙两种物质的饱和溶液都从t2℃降至t1℃时,两种溶液中溶质的质量分数相等时,两种溶液中溶质的质量分数相等 |
| C、向烧杯的水中加NaOH固体后,只有乙溶液中溶质的质量分数变小 |
| D、向烧杯的水加NH4NO3固体后,只有盛放甲溶液的试管中有晶体析出 |
下列有关CO2的实验中,只能证明CO2物理性质的实验是( )
A、 |
B、 |
C、 |
D、 |
下列关于燃烧现象的描述中正确的是( )
| A、铜在空气中受热表面变红色 |
| B、硫粉在氧气中燃烧,产生淡蓝色火焰 |
| C、镁条在空气中燃烧,发出耀眼的白光 |
| D、石蜡在氧气中燃烧,发出白光 |
 向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )
向盛有某液体的烧杯中逐滴加入x溶液至过量(如图1),生成沉淀或气体的质量与加入x溶液的质量关系符合图2的是( )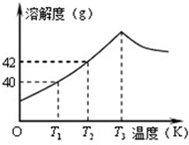 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )