题目内容
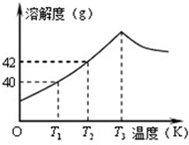 如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )
如图为Na2SO4的溶解度曲线,已知硫酸钠晶体(Na2SO4?10H2O)在温度为T3K时开始分解为无水硫酸钠.现有142g温度为T2 K的饱和硫酸钠溶液,当温度降为T1K或升为T4K(T4>T3)时析出晶体的质量相等,则温度为T4K时Na2SO4的溶解度为( )| A、小于40g |
| B、等于40g |
| C、等于42g |
| D、大于42g |
考点:固体溶解度曲线及其作用,固体溶解度的概念,晶体和结晶的概念与现象
专题:溶液、浊液与溶解度
分析:由图知在T1时溶解度是40g,142g温度为T2K的饱和硫酸钠溶液,当温度降为T1K时,如果析出来的晶体是Na2SO4则有2g,实际应为Na2SO4?10H2O肯定要大于2g.
解答:解:
由图知在T1时溶解度是40g,142g温度为T2K的饱和硫酸钠溶液,当温度降为T1K时,如果析出来的晶体是Na2SO4则有2g,实际应为Na2SO4?10H2O肯定要大于2g.那么在T4K时析出的晶体是无水硫酸钠,质量是大于2g.所以温度为T4K时Na2SO4的溶解度应该小于T1时的溶解度,即小于40g.
故选:A.
由图知在T1时溶解度是40g,142g温度为T2K的饱和硫酸钠溶液,当温度降为T1K时,如果析出来的晶体是Na2SO4则有2g,实际应为Na2SO4?10H2O肯定要大于2g.那么在T4K时析出的晶体是无水硫酸钠,质量是大于2g.所以温度为T4K时Na2SO4的溶解度应该小于T1时的溶解度,即小于40g.
故选:A.
点评:本题考查溶解度、饱和溶液的概念,对于有关溶解度的计算题,找出该温度的饱和溶液,弄清楚硫酸钠晶体(Na2SO4?10H2O)在温度为T3K 时开始分解为无水硫酸钠是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用“ ”和“
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图所示,下列说法正确的是( )

 ”和“
”和“ ”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图所示,下列说法正确的是( )
”代表两种不同的单质分子,它们在一定条件下能发生化学反应,反应前后的模拟模型如图所示,下列说法正确的是( )
A、参加反应的“ ”和“ ”和“ ”分子的个数比是 2:1 ”分子的个数比是 2:1 |
| B、该反应是化合反应 |
| C、该反应有2种生成物 |
| D、该反应不遵循质量守恒定律 |
 甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )| A、甲物质的溶解度比乙物质的溶解度大 |
| B、升温能使甲物质的不饱和溶液变为饱和溶液 |
| C、20℃时,两种物质的饱和溶液中溶质的质量分数相等 |
| D、30℃时,100g甲的饱和溶液中含有25g甲物质 |
推理是化学学习中常用的思维方法.下列推理不正确的是( )
| A、氧化物中都含有氧元素,所以含氧元素的化合物一定是氧化物 |
| B、NaOH溶液中的OH-能与酸反应,则KOH溶液中的OH-也能与酸反应 |
| C、镁位于氢之前它能与盐酸反应,铁也位于氢之前,所以它也能与盐酸反应 |
| D、空气能制取氮气氧气等,它属于混合物.石油能提炼汽油,煤油,采油,所以它也是混合物 |
实验测得气态无水氯化铝在1.01×105Pa、不同温度(t3>t2>t1)时的密度(ρ)和气体摩尔体积(Vm)为:
由此可知,t2℃时无水氯化铝存在形式的化学式( )
| t/℃ | t1 | t2 | t3 |
| ρ/g?L-1 | 5.00 | 2.67 | 1.48 |
| Vm/L?mol-1 | 53.4 | 70.0 | 90.0 |
| A、AlCl3 |
| B、AlCl3和Al2Cl6 |
| C、Al3Cl9 |
| D、Al2Cl6 |
 如图是不含结晶水的甲、乙两种固体物质的溶解度曲线,下列叙述错误的是( )
如图是不含结晶水的甲、乙两种固体物质的溶解度曲线,下列叙述错误的是( )| A、温度小于t1℃时甲的溶解度小于乙的溶解度 |
| B、t1℃配制甲乙两种物质的饱和溶液时,需要相同体积的水 |
| C、t2℃时,将甲、乙的饱和溶液降温至t1℃,肯定都有晶体析出 |
| D、要从含有少量乙的甲溶液中得到较多的甲晶体,通常可采用降温结晶的方法 |
下列各物质中含分子数最多的是( )
| A、0.1mol HCl |
| B、3.01×1023个I2 |
| C、1mol F2 |
| D、0.05mol Br2 |
相同质量的SO2和SO3它们之间的关系是( )
| A、所含硫原子的物质的量之比为1:1 |
| B、氧原子的物质的量之比为3:2 |
| C、氧元素的质量比为2:3 |
| D、硫元素的质量比为5:4 |
