题目内容
4. 俗话说“人以群分、物以类聚”,化学药品柜也一样,同类别的药品放在同一个柜子里
俗话说“人以群分、物以类聚”,化学药品柜也一样,同类别的药品放在同一个柜子里| 药品柜 | 一号柜 | Cu Mg Fe |
| 二号柜 | C P S | |
| 三号柜 | CO2 MgO CuO | |
| 四号柜 | H2SO4 HNO3 HCl | |
| 五号柜 | NaOH Ca(OH)2 Na2CO3 | |
| 六号柜 | KMnO4 NaCl CuSO4 |
(2)六号柜有一位“制氧博士”,实验室由它制取氧气的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)三号柜里住着一位“灭火能手”,检验它的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O.
(4)如图是某个同学做实验时从上面的药品柜中取下试剂,因为操作不当标签被部分腐蚀,根据残缺的标签它最适合的位置应该是四号柜.
分析 (1)NaOH、Ca(OH)2 都属于碱,Na2CO3属于盐,据此分析.
(2)高锰酸钾可用于制取氧气,据此分析.
(3)根据二氧化碳用澄清的石灰水进行检验分析.
(4)根据残缺的标签可知该试剂是酸,进行分析.
解答 解:(1)同种类的物质放在同一个柜子里,NaOH、Ca(OH)2 都属于碱,Na2CO3属于盐,因此错放的是碳酸钠,故填:Na2CO3.
(2)KMnO4、NaCl、CuSO4中高锰酸钾可用于制取氧气,制取氧气的化学方程式2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.故填:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑.
(3)三号柜里的“灭火能手”是二氧化碳,用澄清的石灰水进行检验,检验它的化学方程式:Ca(OH)2+CO2=CaCO3↓+H2O,故填:Ca(OH)2+CO2=CaCO3↓+H2O.
(4)根据残缺的标签可知该试剂是酸,它最适合的位置应该是四号柜,故填:四.
点评 此题难度不大,掌握物质分类的知识和化学方程式的书写方法等即可顺利解答.

练习册系列答案
相关题目
14.如图为元素周期表中的一格,对图中信息解释正确的是( )
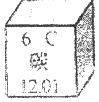

| A. | 核外电子数为12 | B. | 碳原子核内质子数为12 | ||
| C. | 核外电子数为6 | D. | 碳的相对原子质量为12.01g |
15.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们仪器完成以下实验探究.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的.
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
| 实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 | 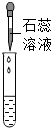 | 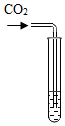 | 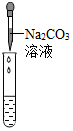 |
| 实验现象 | 溶液变为蓝色 | 溶液变浑浊 | 产生白色沉淀 |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
12.请从A或B两题中任选一个作答,若两题均作答,按35-A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 | B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有⑤⑥⑧(填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅. | (1)过滤需要用到的仪器有②⑨⑪⑫(填序号). (2)蒸发过程中,需不断进行搅拌,其原因是防止局部温度过高,造成液体飞溅. |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 | |
19.在一个密闭的容器中有甲、乙、丙、丁四种物质,在一定条件充分反应,测得反应前后各物质的质量如表,下列正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 3 | 8 | 5 | 4 |
| 反应后质量/g | X | 2 | 5 | 6 |
| A. | 待测值X=4 | |
| B. | 该反应为化合反应 | |
| C. | 丙一定是该反应的催化剂 | |
| D. | 反应过程中甲和丁变化的质量比为2:1 |
9. 根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
(1)既能用排水法,又能用向上排空气法收集的气体是氧气.
(2)标准状况下气体氨气的密度比空气小(填“大”或“小”);
(3)用如图所示盛满水的集气瓶收集氧气,气体应从b(填“a”或“b”)端进入.
 根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:
根据表中五种气体在标准状况下的密度和溶解性,回答下列问题:| 空气 | 氨气 | 甲烷 | 氯化氢 | 氧气 | |
| 密度/g•L-1 | 1.293 | 0.77l | 0.717 | 1.629 | 1.43 |
| 溶解性 | -- | 极易溶 | 难溶 | 极易溶 | 难溶 |
(2)标准状况下气体氨气的密度比空气小(填“大”或“小”);
(3)用如图所示盛满水的集气瓶收集氧气,气体应从b(填“a”或“b”)端进入.
13.金刚石、石墨和C60的化学性质相似,物理性质却有很大差异.其主要原因是( )
| A. | 三种物质的组成元素种类不同 | B. | 构成它们的原子数目不同 | ||
| C. | 三种物质中碳原子的排列方式不同 | D. | 构成它们的原子大小不同 |
14.“除杂”是必须掌握的一项基本化学技能,下表除杂的方法中正确的是( )
| 选项 | 物质2 | 杂质 | 除杂质的方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙、过滤 |
| B | KOH溶液 | KCl | 适量稀盐酸 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液、过滤 |
| D | O2 | CO | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
