题目内容
3.如图是实验室制取气体的有关装置图,据图回答下列问题: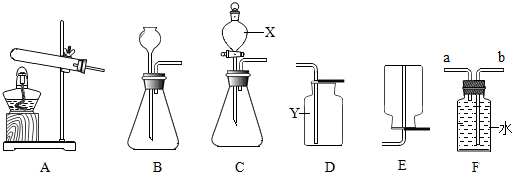
(1)写出图中标号仪器的名称:X分液漏斗,Y集气瓶.
(2)O2的制取方法有多种,若用加热高锰酸钾固体制取O2,应选用的发生装置为A(填装置字母序号),用排空气法收集的装置为D;若以氯酸钾和二氧化锰为原料反应制取O2,其中二氧化锰起催化作用,该反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
(3)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气.
①若用F装置收集氧气,氧气应从a(填“a”或“b”)端通入.
②实验时发现氧气流很不平稳.小涛同学提出可以从如下两个方面加以改进:
一是将制取的装置由B换为图中的C装置(填装置字母序号);
二是将过氧化氢溶液加水稀释.如果把50g溶质质量分数为15%的过氧化氢溶液稀释成溶质质量分数为10%的溶液,需加水的质量为25克.
分析 分液漏斗方便加液体药品,集气瓶是收集气体的仪器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.若用F装置收集氧气,氧气应从短管进入,因为氧气的密度比水小;一是将制取的装置由B换为图中的C装置,因为分液漏斗可以控制反应的速率;有关的计算要正确.
解答 解:(1)分液漏斗方便加液体药品,集气瓶是收集气体的仪器,故答案为:分液漏斗;集气瓶;
(2)如果用氯酸钾制氧气就需要加热,氯酸钾在二氧化锰做催化剂和加热的条件下生成氯化钾和氧气,配平即可,二氧化锰起催化作用;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:A;D;催化;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(3)若用F装置收集氧气,氧气应从短管进入,因为氧气的密度比水小;一是将制取的装置由B换为图中的C装置,因为分液漏斗可以控制反应的速率;设需加水的质量为x,50g×15%=(50g+x)×10%,x=25g;故答案为:①a;②C;25;
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关溶液的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
11.下列各组离子在水溶液中能大量共存的是( )
| A. | H+、Na+、Cl-、HCO3- | B. | H+、K+、Cl-、OH- | ||
| C. | K+、NH4+、Cl-、NO3- | D. | Cu2+、Ba2+、Cl-、SO42- |
12.下表中对部分知识的归纳完全正确的一组是( )
| A、物质的鉴别 | B、低碳生活 |
| ①区分硬水和软水,加肥皂水后搅拌 ②区分棉纤维和羊毛纤维,点燃后闻气味 ③区分硫酸铵和硫酸钾,加熟石灰粉末研磨 | ①出行多乘交通工具 ②生活中用火烧毁废旧塑料和橡胶 ③用废旧报纸制作铅笔杆 |
| C、化学与健康 | D、化学与材料 |
| ①铁、碘、钙是人体必需的微量元素 ②服用含Al(OH)3的药物可治疗胃酸过多 ③油脂是人体重要的营养物质,可大量摄入油脂 | ①钢铁、硬铝和黄铜都是合金 ②纯铁比生铁的硬度更大、熔点更高 ③聚氯乙烯塑料属于有机合成材料 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
18.在化学实验室,小刚和小强意外发现实验桌上有一瓶敞口放置的氢氧化钠固体,他们对这瓶氢氧化钠固体是否变质进行了如下实验探究:
【提出问题】这瓶氢氧化钠固体是否变质?
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质.
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质.
(1)你认为上述实验方案错误的是小刚:理由是碳酸钠溶液显碱性,也能使酚酞试液变红色.
请你设计另外一个方案,证明该瓶氢氧化钠固体已经变质,并完成以下实验报告:
(2)【交流反思】在实验室里氢氧化钠需要密封保存.药品密封保存的原因很多,请你写出浓硫酸需要密封保存的原因浓硫酸能吸收水蒸气.
【提出问题】这瓶氢氧化钠固体是否变质?
【实验探究】为检验这瓶氢氧化钠固体是否变质,小刚和小强设计了如下实验方案:
小刚:取少量样品加适量蒸馏水配成溶液后,滴入几滴酚酞溶液,若观察到溶液变红色,证明该瓶氢氧化钠固体没有变质.
小强:取少量样品加适量蒸馏水配成溶液后,滴入适量澄清石灰水,若观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质.
(1)你认为上述实验方案错误的是小刚:理由是碳酸钠溶液显碱性,也能使酚酞试液变红色.
请你设计另外一个方案,证明该瓶氢氧化钠固体已经变质,并完成以下实验报告:
| 实验步骤 | 实验现象及结论 |
| 取少量样品加适量蒸馏水配成溶液后,滴入适量氯化钙溶液 | 观察到有白色沉淀生成,证明该瓶氢氧化钠固体已经变质 |
15.为测定21.2g久置于空气中的氢氧化钠变质程度.将其配制成500ml溶液,分别取出50ml用两种方法进行测定.
现任选一种方法的数据,通过计算说明氢氧化钠的变质程度.(写出计算过程及结果)
| 加入的试剂 | 测得数据 | |
| 方法1 | 足量的BaCl2溶液 | 产生BaCO3沉淀1.97g |
| 方法2 | 足量的稀硫酸 | 产生CO2气体0.44g |
12.溶液在生产、生活中的应用非常广泛,请认真分析下列各图,回答相关问题.

(1)根据图Ⅰ分析,20℃时,将20gNaCl加入到50g水中形成溶液的质量为68g.
(2)如图Ⅱ所示,打开汽水瓶,冒出大量气泡,说明气体的溶解度与压强的关系是随压强的减小而减小.
(3)向图Ⅲ所示烧杯内的水中加入一定量的硝酸铵,溶解后甲试管内出现的现象是有固体析出;乙试管内溶液中溶质的质量分数不变(选填“变大”“变小”或“不变”).
(4)如表是氯化铵在不同温度时的溶解度.
20℃是按照图所示进行实验操作:

分析B中的溶液时饱和(选填“饱和”或“不饱和”)溶液,C中溶液溶质和溶剂的质量比为2:5.

(1)根据图Ⅰ分析,20℃时,将20gNaCl加入到50g水中形成溶液的质量为68g.
(2)如图Ⅱ所示,打开汽水瓶,冒出大量气泡,说明气体的溶解度与压强的关系是随压强的减小而减小.
(3)向图Ⅲ所示烧杯内的水中加入一定量的硝酸铵,溶解后甲试管内出现的现象是有固体析出;乙试管内溶液中溶质的质量分数不变(选填“变大”“变小”或“不变”).
(4)如表是氯化铵在不同温度时的溶解度.
| 温度/℃ | 0 | 20 | 40 | 60 |
| 溶解度/g | 29.4 | 37.2 | 45.8 | 55.2 |

分析B中的溶液时饱和(选填“饱和”或“不饱和”)溶液,C中溶液溶质和溶剂的质量比为2:5.
 为了研究质量守恒定律,设计了如图“白磷燃烧前后质量测定”的实验,请分析有关问题:
为了研究质量守恒定律,设计了如图“白磷燃烧前后质量测定”的实验,请分析有关问题: