题目内容
某同学做了如下图所示实验:
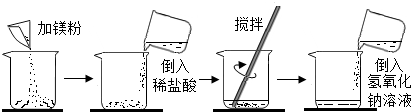
第一次实验每步均恰好完全反应,请回答:
(1)写出第一次实验中发生反应的化学方程式 ;
(2)第二次反应后溶液中溶质的组成是 ;
(3)每次实验巾加入镁的质量(m)为 ;
(4)求解第一次反应中生成气体的质量(X)的比例式为 ;
(5)若将第一次反应后溶液蒸发掉68.4g水后,则所得不饱和溶液中溶质的质量分数 ;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为 .

| 第一次 | 第二次 | |
| 加入镁粉的质量 | m | m |
| 加入质量分数为14.6%稀盐酸的质量 | 50g | lOOg |
| 加入氢氧化钠溶液的质量 | 100g | 100g |
| 加入氢氧化钠溶液后的实验现象 | 产生白色沉淀 | 无明显现象 |
(1)写出第一次实验中发生反应的化学方程式
(2)第二次反应后溶液中溶质的组成是
(3)每次实验巾加入镁的质量(m)为
(4)求解第一次反应中生成气体的质量(X)的比例式为
(5)若将第一次反应后溶液蒸发掉68.4g水后,则所得不饱和溶液中溶质的质量分数
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为
考点:根据化学反应方程式的计算,用水稀释改变浓度的方法,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)镁和稀盐酸反应生成氯化镁和氢气,氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠;
(2)第二次加入氢氧化钠溶液后无明显现象,说明氢氧化钠只能够和稀盐酸反应;
(3)根据第一次实验中镁和稀盐酸反应的关系可以计算每次实验加入镁的质量;
(4)根据稀盐酸的质量、溶质质量分数可以计算第一次反应中生成气体的质量;
(5)根据氯化镁的质量可以计算氢氧化镁的质量和氯化钠的质量,进一步可以计算所得不饱和溶液中溶质的质量分数;
(6)溶液稀释前后,溶质质量不变.
(2)第二次加入氢氧化钠溶液后无明显现象,说明氢氧化钠只能够和稀盐酸反应;
(3)根据第一次实验中镁和稀盐酸反应的关系可以计算每次实验加入镁的质量;
(4)根据稀盐酸的质量、溶质质量分数可以计算第一次反应中生成气体的质量;
(5)根据氯化镁的质量可以计算氢氧化镁的质量和氯化钠的质量,进一步可以计算所得不饱和溶液中溶质的质量分数;
(6)溶液稀释前后,溶质质量不变.
解答:解:(1)镁和稀盐酸、氯化镁和氢氧化钠反应的化学方程式分别是:
Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
故填:Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(2)第二次反应后溶液中溶质有镁和稀盐酸反应生成的氯化镁、氢氧化钠和稀盐酸反应生成的氯化钠.
故填:NaCl、MgCl2.
(3)设镁的质量为x,生成氯化镁的质量为y,生成氢气的质量为z,
Mg+2HCl=MgCl2 +H2↑,
24 73 95 2
x 50g×14.6% y z
=
=
=
,
x=2.4g,y=9.5g,z=
=0.2g,
故填:2.4g.
(4)第一次反应中生成气体的质量(X)的比例式为
,
故填:
.
(5)设生成氯化钠的质量为m,生成氢氧化镁的质量为n,
MgCl2+2NaOH=Mg(OH)2↓+2NaCl,
95 58 117
9.5g n m
=
=
,
m=11.7g,n=5.8g,
则所得不饱和溶液的质量为:2.4g+50g+100g-0.2g-5.8g-68.4g=78g,
则所得不饱和溶液中溶质的质量分数为:
×100%=15%,
故填:15%.
(6)150g稀盐酸中氯化氢的质量为:150g×14.6%=21.9g,
需要36.5%的浓盐酸的质量为:21.9g÷36.5%=60g,
需要水的质量为:150g-60g=90g,
故填:90g.
Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
故填:Mg+2HCl=MgCl2+H2↑、MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(2)第二次反应后溶液中溶质有镁和稀盐酸反应生成的氯化镁、氢氧化钠和稀盐酸反应生成的氯化钠.
故填:NaCl、MgCl2.
(3)设镁的质量为x,生成氯化镁的质量为y,生成氢气的质量为z,
Mg+2HCl=MgCl2 +H2↑,
24 73 95 2
x 50g×14.6% y z
| 24 |
| x |
| 73 |
| 50g×14.6% |
| 95 |
| y |
| 2 |
| z |
x=2.4g,y=9.5g,z=
| 50g×14.6%×2 |
| 73 |
故填:2.4g.
(4)第一次反应中生成气体的质量(X)的比例式为
| 50g×14.6%×2 |
| 73 |
故填:
| 50g×14.6%×2 |
| 73 |
(5)设生成氯化钠的质量为m,生成氢氧化镁的质量为n,
MgCl2+2NaOH=Mg(OH)2↓+2NaCl,
95 58 117
9.5g n m
| 95 |
| 9.5g |
| 58 |
| n |
| 117 |
| m |
m=11.7g,n=5.8g,
则所得不饱和溶液的质量为:2.4g+50g+100g-0.2g-5.8g-68.4g=78g,
则所得不饱和溶液中溶质的质量分数为:
| 11.7g |
| 78g |
故填:15%.
(6)150g稀盐酸中氯化氢的质量为:150g×14.6%=21.9g,
需要36.5%的浓盐酸的质量为:21.9g÷36.5%=60g,
需要水的质量为:150g-60g=90g,
故填:90g.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
某同学想测定一瓶已变质的氢氧化钠溶液中钠元素的质量分数.他取一定量的该氢氧化钠溶液注入烧杯中,然后又加入14.6%的稀盐酸,充分搅拌,直到刚好不再产生气泡为止,发现所用稀盐酸的质量与所取氢氧化钠溶液的质量恰好相等,则瓶内氢氧化钠溶液中钠元素的质量分数为( )
| A、4.6% | B、9.2% |
| C、5.3% | D、11.2% |
温度计中的液态金属俗称水银,其化学符号为( )
| A、Ag | B、Hg | C、H | D、He |