题目内容
6.有一包白色固体可能含碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.为探究其成分,进行如下实验:第一步:取少量固体于烧杯中,逐渐加水并不断搅拌,烧杯内固体的质量随加入水的质量的变化如图1所示;
第二步:取少量B点时的清液于试管中,滴加酚酞试液,酚酞试液不变色;
第三步:继续向烧杯中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.

请根据上述实验回答:
①图2中,BC段减少的沉淀是BaCO3(填化学式),从C到D液体的pH减小(填“增大”、“减小”或“不变”).
②原白色固体中,在图1B点所对应的清液中,肯定不存在的是氢氧化钠、碳酸钠.图2中,D点所对应的溶液中一定含有的溶质是硝酸钠、硝酸钡、硝酸;
③由上述实验不能确定的物质是氯化钾,通过下列方案进一步确定该白色固体的成分:
方案一:取少量B点时的清液于试管中,利用酒精灯、洁净的铂丝进行焰色反应,透过蓝色的钴玻璃观察到火焰呈紫色,确定该物质存在.
方案二:取少量B点时的清液于试管中,加过量的硝酸钡,过滤;再向滤液中加入硝酸银溶液,观察现象,确定该物质是否存在.
分析 根据碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠都是可溶于水的物质,由图1可知,加入水,有不溶物,说明了上述物质间发生反应生成了沉淀,由于碳酸钠、硫酸钠都能与硝酸钡反应生成沉淀,由此可知,一定存在硝酸钡;由图2可知沉淀加入稀硝酸沉淀部分溶解,沉淀应为碳酸钡和硫酸钡的混合物,说明了原混合物中一定有碳酸钠和硫酸钠.由取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色,说明了不含有氢氧化钠,据此分析回答有关的问题.
解答 解:由图1可知,加入水,有不溶物,说明了上述物质间发生反应生成了沉淀,由于碳酸钠、硫酸钠都能与硝酸钡反应生成沉淀,由此可知,一定存在硝酸钡;由图2可知沉淀加入稀硝酸后,沉淀部分溶解,沉淀应为碳酸钡和硫酸钡的混合物,说明了原混合物中一定有碳酸钠和硫酸钠;由取少量B点时的清液于试管中,滴加酚酞溶液,酚酞溶液不变色,说明了不含有氢氧化钠.
(1)由上述分析可知,BC段可观察到的现象是固体部分溶解,有气泡冒出,从C到D液体的酸性增强,液体的pH减小;
(2)原白色固体中,在图1B点所对应的清液中,肯定不存在的是氢氧化钠、碳酸钠.图2中,D点时,溶液中一定含有的溶质是硝酸钠、硝酸钡、硝酸;
(3)由上述实验不能确定的物质是氯化钾,通过下列方案进一步确定该白色固体的成分:
方案一:取少量B点时的清液于试管中,利用酒精灯、洁净的铂丝进行焰色反应,透过蓝色的钴玻璃观察到火焰呈紫色,确定该物质有“钾”元素存在.
方案二:取少量B点时的清液于试管中,加过量的硝酸钡,过滤;再向滤液中加入硝酸银溶液,观察现象,若有白色沉淀生成则证明含有氯化钾,否则则没有.
故答案为:
①BaCO3,减小.
②氢氧化钠、碳酸钠. 硝酸钠、硝酸钡、硝酸;
③氯化钾,紫.过量的硝酸钡,硝酸银溶液,
点评 本题主要考查了物质的鉴别和推断,难度稍大,了解碳酸根离子、硫酸根离子、氯离子的检验方法是解答本题的关键.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案①Fe2+②Fe③SO2④Fe3+⑤NaCl.
| A. | 能表示一个分子的是③ | B. | 表示物质组成的化学式是②③⑤ | ||
| C. | ①②④属于同一种元素 | D. | ③中的数字“2”表示2个氧原子 |
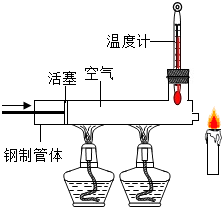 已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成.如图所示,在温度计
已知蜡烛的着火点约为190℃,蜡烛的火焰由气态蜡燃烧形成.如图所示,在温度计示数为280℃以上时,快速推动活塞,观察到蜡烛立即熄灭.蜡烛熄灭的主要原因是( )
| A. | 隔绝氧气 | B. | 移走可燃物 | ||
| C. | 降低温度至着火点以下 | D. | 无法判断 |
| A. | 湿衣晒干 | B. | 冰雪融化 | C. | 粮食发酵 | D. | 矿石粉碎 |
| A. | 用二氧化锰鉴别水和过氧化氢溶液 | |
| B. | 用石蕊试液鉴别一氧化碳和二氧化碳 | |
| C. | 用氯化钡溶液鉴别稀盐酸和稀硫酸 | |
| D. | 用酚酞试液鉴别食盐水和稀醋酸 |
| A. | 在室内放一盆水可以防止一氧化碳中毒 | |
| B. | 发现天然气泄漏,立即开启抽油烟机 | |
| C. | 用肥皂水区分硬水和软水 | |
| D. | 向刚刚用熟石灰改良过的酸性土壤中施用铵态氮肥 |
| A. | Zn | B. | NaOH | C. | Fe2O3 | D. | CaCO3 |
| 甲 | 乙 | 丙 | |
| A | Fe2O3 | CO | 稀盐酸 |
| B | H2 | Cl2 | CuO |
| C | Ba(NO3)2溶液 | 稀硫酸 | NaOH溶液 |
| D | CO2 | Ca(OH)2溶液 | H2O |
| A. | A | B. | B | C. | C | D. | D |
