题目内容
12.化学小组收集到洗照片用过的硝酸银废液,利用废铁、废锌回收金属银.他们将金属混合物加入到硝酸银废液中,充分反应后过滤,得到固体和浅绿色溶液(忽略其他杂质).(1)写出生成浅绿色溶液的化学方程式Fe+2AgNO3=Fe(NO3)2+2Ag
(2)为了探究滤液中溶质的可能组成,他们做出以下猜想:
①溶质为硝酸锌②溶质为硝酸亚铁和硝酸银③溶质为硝酸锌、硝酸亚铁④溶质为硝酸锌、硝酸亚铁、硝酸银
上述猜想中正确的是③④
(3)小组同学继续实验验证所得银粉固体中是否含有铁粉:甲同学用简单的物理方法证明了固体中含有铁粉.他的方法是用磁铁吸引.乙同学设计了化学方法是往固体粉末中加入足量的稀硫酸,他判断已充分反应的依据是没有气泡产生.
分析 锌的金属性强于铁,故锌先和硝酸银反应转变为溶质,因此先有硝酸锌,后有硝酸亚铁;根据过滤后的滤液的颜色判断反应的溶液中一定含有硝酸亚铁,因硝酸锌和硝酸银溶液都是无色的;结合铁的物理性质和化学性质分析.
解答 解:(1)溶液为浅绿色溶液,说明铁和硝酸银反应产生硝酸亚铁和银,故反应的方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag;
(2)锌的金属性强于铁,故锌先和硝酸银反应转变为溶质,因此先有硝酸锌,后有硝酸亚铁;因为溶液为浅绿色,故溶液中一定含有硝酸亚铁,那么锌就没有剩余,溶液中一定含有硝酸锌,还可能含有硝酸银,故答案为:③④;
(3)铁能够被磁铁吸引,属于物理方法,因此可以利用磁铁吸引法验证铁的存在;铁粉充分反应,则加入稀硫酸就不会产生气泡;故答案为:用磁铁吸引;没有气泡产生.
点评 本题主要考查了对金属活动性顺序的应用,根据金属的活动性强弱判断反应是否发生,及根据反应是否发生判断物质的存在,培养学生分析问题、解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.如图是A、B、C三种物质的溶解度曲线,下列分析正确的是( )


| A. | A的溶解度比B大 | |
| B. | 50℃时把50gA放入100g水中能得到A的饱和溶液,其中溶质与溶液的质量比为1:2 | |
| C. | 将A的饱和溶液变为不饱和溶液,可采用升温的方法 | |
| D. | 将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C |
20.水是生命之源,保护水资源、防止水污染是每个公民的责任.下列做法有利于防止水资源污染的是( )
①农业生产中合理使用农药和化肥
②工业废水处理达标后再排放
③不用含磷洗衣粉
④生活污水随意排放.
①农业生产中合理使用农药和化肥
②工业废水处理达标后再排放
③不用含磷洗衣粉
④生活污水随意排放.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
7.类推是常用的思维方法,以下类推成立的是( )
| A. | 燃着的木条伸入装有二氧化碳的集气瓶中熄灭,所以使燃着的木条熄灭的气体一定是二氧化碳 | |
| B. | 分子可以构成物质,所以构成物质的粒子一定是分子 | |
| C. | 氧化物含有氧元素,所以含氧的化合物一定是氧化物 | |
| D. | 醋酸是酸,它能使石蕊溶液变红,所以碳酸一定能使石蕊溶液变红 |
11.用置换反应验证锌的金属活动性比铜强,下列各组药品不能达到目的是( )
| A. | Fe、ZnSO4、CuSO4 | B. | Zn、Cu、H2SO4 | C. | Zn、Cu、FeSO4 | D. | Zn、Cu、AgNO3 |
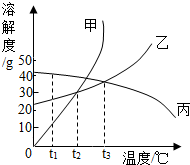 如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题:
如图是甲、乙、丙三种固体物质的溶解度曲线,回答下面问题: