题目内容
实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
(2)计算原过氧化氢溶液中过氧化氢的质量.
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算.
【分析】(1)根据二氧化锰是过氧化氢分解的催化剂,反应前后质量不变.
(2)利用分解过氧化氢制氧气的化学方程式,根据氧气的质量求出过氧化氢的质量.
【解答】解:(1)反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量就是二氧化锰的质量,是2.5g;
(2)设:生成1.6g气体需要该过氧化氢溶液中溶质的质量为x
2H2O2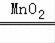
 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
根据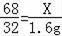
 ,
,
解得x=3.4g
答:原过氧化氢溶液中过氧化氢的质量为3.4g.
【点评】本道题目比较简单,是一道最基本的根据化学方程式的计算题,解题关键是根据质量守恒定律求出氧气的质量.

氯气(Cl2)是黄绿色气体,溶于水时部分以Cl2分子存在于溶液中,部分与水反应Cl2+H2O═HCl+HClO.产物中,次氯酸(HClO)是一种弱酸.氯气溶于水所得溶液称为氯水,它具有很强的漂白性.把品红试纸(染有品红颜料的滤纸)放入氯水中,品红试纸褪色.晓红同学对“氯水使品红试纸褪色”产生浓厚兴趣,她所在的学习小组进行了如下探究,请你一起来完成:
【提出问题】氯水中的什么成分使品红试纸褪色?
【猜想】猜想1:氯水中的水使品红试纸褪色; 猜想2:氯水中的Cl2使品红试纸褪色;
猜想3:氯水中的盐酸使品红试纸褪色; 猜想4:氯水中的 使品红试纸褪色.
【实验探究】
| 实验操作 | 实验现象 | 结论 |
| ①把品红试纸放入水中 | 品红试纸不褪色 | 猜想1 |
| ② 把品红试纸放入氯气中 | 试纸不褪色 | 猜想2不成立 |
| ③ 把品红试纸放入稀盐酸中 | 试纸不褪色 | 猜想3不成立 |
【结论】学习小组通过讨论,找到了氯水中使品红试纸褪色的物质.
【反思】向氯水中滴加几滴紫色石蕊试液,会观察到的现象是 .
【拓展】铁能在氯气中燃烧生成氯化铁,请写出该反应的化学方程式 .

用久置的镁条做实验时,需要用砂纸把表面的灰黑色打磨掉,直到露出光亮的银白色。实验小组同学对镁条表面“灰黑色外衣”的成分进行如下探究。
【提出问题】镁条表面“灰黑色外衣”的成分是什么?
【猜想与假设】
Ⅰ.是镁与空气中的氧气反应生成的氧化镁。
Ⅱ.是镁与空气中的二氧化碳反应生成的黑色碳单质。
Ⅲ.根据铜锈的成分是碱式碳酸铜,推测镁条表面的“灰黑色外衣”是镁在潮湿的空气中生锈得到的碱式碳酸镁。
同学们经讨论,从颜色上否定了只含有氧化镁,因为氧化镁是________。
【查阅资料】
① 碱式碳酸镁的性质有:受热可分解;常温下能与稀硫酸反应。
② 白色的硫酸铜粉末遇水能变为蓝色。
③ 碳不与稀硫酸反应,但与浓硫酸在加热条件下能反应并生成CO2、SO2和H2O。
同学们认为碳与浓硫酸反应生成三种产物的共同点是 (答出一点即可)。
【进行实验】
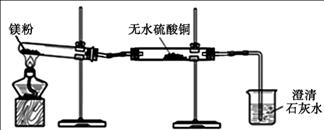
(1)同学们用久置的镁粉进行了如下实验。
| 实 验 装 置 |
|
| 实 验 现 象 | ①无水硫酸铜粉末逐渐由白色变为蓝色 ②澄清石灰水变浑浊 |
| 结 论 | 久置的镁粉中除镁元素外,还含有的元素是 久置的镁粉中含有碱式碳酸镁 |
(2)同学们发现,经加热一段时间后,试管中镁粉会突然“噗”地燃烧起来,出现红热,很快停止,并有黑色固体粘附在试管壁上。
①将试管取下,冷却后加入足量稀硫酸,大部分固体溶解,并有气泡出现,但黑色固体没有消失。请写出有气体生成的一个反应化学方程式________。
②将实验①试管中的混合物进行______ _(填操作名称),除去其中溶液,向黑色固体中加入浓硫酸,加热。黑色固体全部溶解,得澄清溶液并伴有刺激性气味的气体产生。
实验(2)说明,镁在CO2中可以燃烧,生成了碳单质。
【实验结论】
综合上述实验现象,实验小组认为镁条表面“灰黑色外衣”中含有碳和碱式碳酸镁。
【反思与评价】
有的同学提出,实验(2)不足以证明镁条表面“灰黑色外衣”中含有碳,他的理由是_____________。
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验 (石灰石的主要成分是CaCO3 ,高温煅烧生成CaO和CO2 , 所含杂质在煅烧过程中不发生变化)。测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的含量(写出计算过程)。
 不成立
不成立

 定的空隙
定的空隙