题目内容
10.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染源之一”而加以控制.铝在下列场合须加以控制的是( )①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食品膨化剂 ⑧用氢氧化铝制胃药 ⑨制防锈油漆.
| A. | ①②④⑤⑥⑦⑧ | B. | ②④⑤⑥⑦⑧ | C. | ②⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
分析 铝在人体内积累可使人慢性中毒,铝进入人体的主要途径是通过消化系统,既然铝是食品污染源之一,凡与人的食用物品及口腔接触的物品都必须控制铝的使用,据此分析解答.
解答 解:①制铝锭与人口腔不接触,所以不需要控制,故①错误;
②制易拉罐,铝元素随饮料通过消化系统进入人体,需要加以控制,故②正确;
③铝不会因使用电缆进入人体,与人体健康无关,无需控制,故③错误;
④牙膏皮上的铝能随通过消化系统进入人体,需要加以控制,故④正确;
⑤用明矾净水,铝元素随水通过消化系统进入人体,需要加以控制,故⑤正确;
⑥制炊具和餐具,与人口腔接触,需要控制,故⑥正确;
⑦用明矾和苏打作食物膨化剂,与人口腔接触,需要控制,故⑦正确;
⑧用氢氧化铝制胃药,与人口腔接触,需要控制,故⑧正确;
⑨制防锈油漆,与人口腔不接触,所以不需要控制,故⑨错误;
故选B.
点评 本题考查铝的性质与人体健康,为高考常见题型和高频考点,掌握铝可能进入人体的途径(如铝可以通过饮食、药物等途径进入人体从而危害人体健康)是解题的关键,题目难度不大.

练习册系列答案
相关题目
20.下列关于实验现象的描述错误的是( )
| A. | 石灰石与稀盐酸混合后白色固体表面产生大量二氧化碳气体 | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合溶液中产生蓝色絮状沉淀 | |
| C. | 蜡烛燃烧放出热量 | |
| D. | 向装有人呼出气体的集气瓶中滴入几滴澄清石灰水,澄清石灰水变白色浑浊 |
1.除去下列物质中的杂质,所选用的试剂和操作方法都正确的是( )
| 选项 | 物质 | 杂质(少量) | 试剂及操作方法 |
| A | 铁 | 硫酸铜 | 加入足量水,过滤,洗涤,干燥 |
| B | 碘 | 高锰酸钾 | 加入足量水溶解,过滤,洗涤,干燥 |
| C | 硝酸亚铁溶液 | 硝酸银 | 加入足量的锌,过滤,蒸发,结晶 |
| D | 锌粉 | 铜 | 加入足量的稀盐酸,过滤,洗涤,干燥, |
| A. | A | B. | B | C. | C | D. | D |
15.实验室中有一瓶烧碱固体,打开瓶盖在空气中一段时间后,小王认为它可能变质,请你和他一起探究.
(1)小王认为烧碱暴露在空气中会变质的原因是:2NaOH+CO2═Na2CO3+H2O(写化学方程式),所以保存氢氧化钠必须密封.
(2)小王认为这瓶烧碱的可能组成有:A、全部是烧碱;B、全部是碳酸钠;小李认为还有第三种可能性,请你说出是烧碱和碳酸钠.
(3)对于第三种可能性,小李设计了一下的探究实验,请你帮他一起完成:
(4)请你写出上面第二步的化学方程式:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
(5)你认为小李的第二步设计正确吗?说出理由不正确,因为氢氧化钙溶液显碱性,过量的氢氧化钙溶液能使酚酞试液变红色;再有氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,氢氧化钠能使酚酞试液变红色.
(6)除上面用到的检验固体中含有碳酸钠的方法外,请你用另外一种不同类别的物质检验固体中含有碳酸钠,这种试剂是氯化钙,反应的化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl.
(7)小赵认为检验固体中有氢氧化钠的实验可以这样设计:取少量固体,加水充分溶解,往其中滴加酚酞试剂,变红色,呈碱性,说明固体中还有氢氧化钠.这种设计合理吗?说明理由不合理,因为碳酸钠溶液也显碱性,即使固体中没有氢氧化钠,溶液也能使酚酞试液变红色.
(1)小王认为烧碱暴露在空气中会变质的原因是:2NaOH+CO2═Na2CO3+H2O(写化学方程式),所以保存氢氧化钠必须密封.
(2)小王认为这瓶烧碱的可能组成有:A、全部是烧碱;B、全部是碳酸钠;小李认为还有第三种可能性,请你说出是烧碱和碳酸钠.
(3)对于第三种可能性,小李设计了一下的探究实验,请你帮他一起完成:
| 实验步骤 | 现象 | 结论 |
| 1.取少量固体,往其中滴加稀盐酸. | 有气泡冒出 | 固体中含有碳酸钠 |
| 2、另取少量固体,加水充分溶解,加入过量的氢氧化钙溶液. | 产生白色沉淀 | 固体中含有碳酸钠. |
| 3、对上述反应后的混合物过滤,在滤液中加入酚酞溶液. | 变红色 | 固体中含有氢氧化钠. |
(5)你认为小李的第二步设计正确吗?说出理由不正确,因为氢氧化钙溶液显碱性,过量的氢氧化钙溶液能使酚酞试液变红色;再有氢氧化钙和碳酸钠反应生成碳酸钙和氢氧化钠,氢氧化钠能使酚酞试液变红色.
(6)除上面用到的检验固体中含有碳酸钠的方法外,请你用另外一种不同类别的物质检验固体中含有碳酸钠,这种试剂是氯化钙,反应的化学方程式CaCl2+Na2CO3═CaCO3↓+2NaCl.
(7)小赵认为检验固体中有氢氧化钠的实验可以这样设计:取少量固体,加水充分溶解,往其中滴加酚酞试剂,变红色,呈碱性,说明固体中还有氢氧化钠.这种设计合理吗?说明理由不合理,因为碳酸钠溶液也显碱性,即使固体中没有氢氧化钠,溶液也能使酚酞试液变红色.
2.在下列变化中,属于氧化反应但不属于化合反应的是( )
| A. | 碳+氧气$\stackrel{点燃}{→}$二氧化碳 | B. | 酒精+氧气$\stackrel{点燃}{→}$二氧化碳+水 | ||
| C. | 氧化汞$\stackrel{加热}{→}$汞+氧气 | D. | 镁+氧气$\stackrel{点燃}{→}$氧化镁 |
19. 钢铁工业是国家工业的基础.
钢铁工业是国家工业的基础.
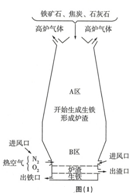
(1)如图(1)是炼铁高炉及炉内化学变化过程示意图.
根据图示回答下列问题.
若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:
A区Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
B区C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
(2)某兴趣小组利用图(2)实验装置测定某赤铁矿石样品中Fe2O3的质量分数,取10g样品与足量CO充分反应后,测得剩余固体的质量为7.6g,下列说法正确的是D(温馨提示:杂质不参加反应)
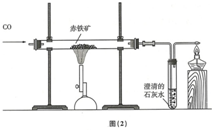
A.玻璃管中的固体由黑色逐渐变成红色
B.实验中通入CO的质量为4.2g
C.生成CO2的质量为2.4g
D.铁矿石样品中Fe2O3的质量分数为80%
(3)小组同学又用一氧化碳还原纯净的氧化铁粉末,同时对固体产物的成分进行探究.
该小组按图(3)实验设计,在一定温度下进行了实验,测得下列数据:
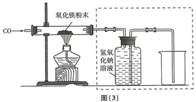
①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却至室温称量)
【分析与讨论】
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,她质疑的理由是如果黑色固体全部是铁,则质量应该为:6.0g×70%=4.2g,不应该是5.8g.于是大家提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁
③
【实验与猜想】
①该小组的同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能是
a.四氧化三铁 b.四氧化三铁和铁
【得出结论】
通过实验中获得的数据进行计算,得出黑色固体粉末为四氧化三铁(写名称).
【反思与评价】
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图(3)中采用虚线框内的装置,其作用有AB.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
③工业上炼出的生铁与实验还原出来的铁有什么区别?工业上炼出的生铁中含有碳,而实验还原出来的铁中不含有碳.将工业上炼出的生铁少量放于烧杯中,加入足量稀盐酸的现象是固体部分溶解,产生气泡,溶液变成浅绿色.
 钢铁工业是国家工业的基础.
钢铁工业是国家工业的基础.(1)如图(1)是炼铁高炉及炉内化学变化过程示意图.
根据图示回答下列问题.
若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式:
A区Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
B区C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO.
(2)某兴趣小组利用图(2)实验装置测定某赤铁矿石样品中Fe2O3的质量分数,取10g样品与足量CO充分反应后,测得剩余固体的质量为7.6g,下列说法正确的是D(温馨提示:杂质不参加反应)

A.玻璃管中的固体由黑色逐渐变成红色
B.实验中通入CO的质量为4.2g
C.生成CO2的质量为2.4g
D.铁矿石样品中Fe2O3的质量分数为80%
(3)小组同学又用一氧化碳还原纯净的氧化铁粉末,同时对固体产物的成分进行探究.
该小组按图(3)实验设计,在一定温度下进行了实验,测得下列数据:

①反应前玻璃管和内盛氧化铁粉末的总质量66.0g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量65.8g(冷却至室温称量)
【分析与讨论】
本实验中,玻璃管内固体粉末由红色全部变为黑色.小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,她质疑的理由是如果黑色固体全部是铁,则质量应该为:6.0g×70%=4.2g,不应该是5.8g.于是大家提出查阅资料.
【查阅资料】
①一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关.
②一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁
③
| 物质 性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
①该小组的同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体粉末全部能被吸引,则该黑色固体粉末中不可能含有氧化铁和氧化亚铁.
②进行猜想:黑色固体粉末可能是
a.四氧化三铁 b.四氧化三铁和铁
【得出结论】
通过实验中获得的数据进行计算,得出黑色固体粉末为四氧化三铁(写名称).
【反思与评价】
①一氧化碳还原氧化铁的实验中,若要得到铁可适当提高反应温度和延长反应时间.
②实验装置图(3)中采用虚线框内的装置,其作用有AB.
A.收集一氧化碳 B.吸收二氧化碳 C.检验二氧化碳.
③工业上炼出的生铁与实验还原出来的铁有什么区别?工业上炼出的生铁中含有碳,而实验还原出来的铁中不含有碳.将工业上炼出的生铁少量放于烧杯中,加入足量稀盐酸的现象是固体部分溶解,产生气泡,溶液变成浅绿色.
20.在化学反应2A+B=2C中,设有6克A和B完全反应生成14克的C,若B的相对分子质量是32,则c 的相对分子质量为( )
| A. | 56 | B. | 28 | C. | 20 | D. | 44 |