题目内容
2.下列各组物质在水溶液中能够大量共存,且都能为无色透明的一组是( )| A. | NaCl、Ba(NO3)2、KOH | B. | CaCl2、K2CO3、AgNO3 | ||
| C. | NaNO3、Fe(NO3)3、HCL | D. | H2SO4、Ba(NO3)2、K2CO3 |
分析 本题考查利用复分解反应的条件来判断物质能否共存的问题,若物质在水中解离成的离子重新结合生成水或气体或沉淀时,物质就不能共存;本题还要注意能得到无色透明溶液,则应注意常见离子在水中的颜色.
解答 解:A、三者之间不反应,且都是无色透明溶液,故此选项正确;
B、氯化钙和硝酸银反应产生氯化银沉淀,碳酸钾和氯化钙反应产生碳酸钙沉淀,不能共存,故此选项错误;
C、三者之间不反应,但硝酸铁是黄色的溶液,故此选项错误;
D、三者之间都能够反应,碳酸钾和硝酸钡反应产生碳酸钡沉淀,碳酸钠和硫酸反应产生水和二氧化碳,都不能共存,故此选项错误;
故答案为:A.
点评 本题主要考查了离子的共存和溶液的带色问题,混合后会生成沉淀、气体、水的不能共存,还要注意常见离子在水中的颜色.

练习册系列答案
相关题目
12.下列实验操作能达到实验目的是( )


| A. | ①实验可以验证质量守恒定律 | |
| B. | ②实验中可以证明金属活动性为Fe>Cu>Ag | |
| C. | ③U形管中液面变化可以鉴别氯化钠和氢氧化钠 | |
| D. | ④中根据小气球变大可以证明氢氧化钠与二氧化碳发生反应 |
13. 如图所示,弹簧秤下挂一重物,重物浸泡在硫酸溶液中,稳定时弹簧秤的度数为F1.进行下列操作;
如图所示,弹簧秤下挂一重物,重物浸泡在硫酸溶液中,稳定时弹簧秤的度数为F1.进行下列操作;
(1)向烧杯中加入足量的铁粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的度数为F2.
(2)再向烧杯中加入过量的氧化铜粉末,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的度数为F3.
假设重物与前、后溶液均不发生任何反应,也不会附上任何反应的生成物,下列说法正确的是( )
 如图所示,弹簧秤下挂一重物,重物浸泡在硫酸溶液中,稳定时弹簧秤的度数为F1.进行下列操作;
如图所示,弹簧秤下挂一重物,重物浸泡在硫酸溶液中,稳定时弹簧秤的度数为F1.进行下列操作;(1)向烧杯中加入足量的铁粉,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的度数为F2.
(2)再向烧杯中加入过量的氧化铜粉末,充分搅拌并静置足够的时间后,溶液的体积未变,此时弹簧秤的度数为F3.
假设重物与前、后溶液均不发生任何反应,也不会附上任何反应的生成物,下列说法正确的是( )
| A. | 弹簧秤的度数F1小于F2 | |
| B. | F2与F3大小无法比较 | |
| C. | 反应中只发生置换和复分解反应 | |
| D. | 操作2过程中重物受到的浮力一直减小 |
17.下列常见材料中,属于无机材料的是( )
| A. | 玻璃钢 | B. | 陶瓷 | C. | 塑料 | D. | 尼龙 |
12. 一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某小组为探究其成分进行如下实验:
一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某小组为探究其成分进行如下实验:
Ⅰ.取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红
Ⅲ.向实验Ⅰ所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.
①CD段可观察到的现象是固体部分溶解,有气泡冒出,从D到E的溶液的pH减小(填“增加”、“减小”、“不变”).
②根据上述实验得出原固体中一定有碳酸钠、硫酸钠、硝酸钡.
③为进一步探究该白色固体成分,进行如下实验
 一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某小组为探究其成分进行如下实验:
一包白色固体中可能含有碳酸钠、硫酸钠、氯化钾、硝酸钡、氢氧化钠中的一种或几种.某小组为探究其成分进行如下实验:Ⅰ.取少量固体于烧杯中逐渐加水并不断搅拌,烧杯中固体质量随加入的水的质量变化如图1所示
Ⅱ.取少量B点时的清液于试管中,滴加酚酞溶液,酚酞变红
Ⅲ.向实验Ⅰ所得的混合物中滴加稀硝酸并不断搅拌,烧杯内固体的质量随加入稀硝酸的质量的变化如图2所示.
①CD段可观察到的现象是固体部分溶解,有气泡冒出,从D到E的溶液的pH减小(填“增加”、“减小”、“不变”).
②根据上述实验得出原固体中一定有碳酸钠、硫酸钠、硝酸钡.
③为进一步探究该白色固体成分,进行如下实验
| 步骤 | 现象 | 结论 |
| 取实验Ⅱ反应后的溶液于试管中, 加入过量硝酸钡 | 溶液红色不褪去 | 原固体中有氢氧化钠 |
| 取实验Ⅱ反应后的溶液于试管中, 加入过量硝酸酸化,再加入硝酸银 | 红色褪去,无白色沉淀 | 无氯化钾 |
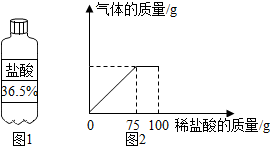 某合作学习小组的同学们为测定某石灰石的质量分数,将溶质质量分数为7.3%的稀盐酸加入10g石灰石样品中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不含钙元素,不与稀盐酸反应).
某合作学习小组的同学们为测定某石灰石的质量分数,将溶质质量分数为7.3%的稀盐酸加入10g石灰石样品中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不含钙元素,不与稀盐酸反应). 甲、乙两种物质的溶解度曲线如图所示.请回答以下问题:
甲、乙两种物质的溶解度曲线如图所示.请回答以下问题: