题目内容
12.如图1表示的是甲、乙两种固体物质的溶解度曲线,清回答下列问题: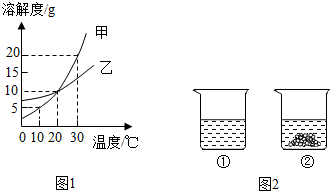
(1)甲、乙溶解度相等时的温度为20℃.
(2)10℃时,向50g水中加入5g甲,充分溶解,所得溶液中溶质与溶剂的质量比为1:20.
(3)30℃时,甲的饱和溶液中含有少量的乙,现要提纯甲,可采用的方法是降温结晶(或冷却热饱和溶液).
(4)30℃时,向分别盛有相同质量的甲、乙的烧杯中,各加入100g水,充分溶解后,其结果如图2所示.下列有关说法,正确的是BD(填字母序号).
A.①烧杯中的溶液是不饱和溶液.
C.升高温度或增加溶剂都有可能将②烧杯中固体全部溶解.
C.若将②烧杯中的溶液变为不饱和溶液,溶液中溶质的质量分数一定会减少.
D.将得到的①烧杯中溶液降温至0℃时,溶液质量分数一定会减少.
分析 (1)溶解度曲线的交点表示该温度下,物质的溶解度相等;
(2)根据甲的溶解度可以判断饱和溶液中溶质与溶剂的质量比;
(3)甲的溶解度随着温度的升高而增大,且变化较大,乙的溶解度受温度影响没有甲明显;
(4)根据实验现象可以判断相关方面的问题.
解答 解:(1)20℃时,甲乙的溶解度曲线交于一点,二者的溶解度相同;
(3)10℃时甲的溶解度是5g,即100g水中最多溶解5g的甲,所以向50g水中加入5g甲,充分溶解,最多溶解2.5g的甲,所得溶液中溶质与溶剂的质量比为 2.5g:50g=1:20;
(3)30℃时,甲的饱和溶液中含有少量的乙,现要提纯甲,可采用降温结晶或冷却热饱和溶液的方法,因为甲的溶解度变化比乙大;
(4)30℃时,向分别盛有相同质量的甲、乙的烧杯中,各加入100g水,充分溶解后,由图示可知①中溶质全部溶解,而②中有剩余晶体,说明该温度下①的溶解度大于②,则①是甲的溶解度曲线,②是乙的溶解度曲线;
A、由图示可知①中溶质全部溶解,全部溶解可能刚好饱和,也可能不饱和,所以A错误;
B、乙的溶解度随温度升高而增大,所以使烧杯②中固体全部溶解,可以采用升高温度或增加溶剂的方法,正确;
C、将烧杯②中的溶液变为不饱和溶液,可用加溶剂和升温的方法,若用升温至恰好饱和的方法,溶液中的溶质、溶剂质量不变,溶质质量分数不变,故错误;
D、由图示可知②中有剩余晶体,说明该温度下加入的固体的质量一定大于30℃时乙的溶解度,若将得到的①烧杯中溶液降温至0℃时,甲的溶解度大大降低,小于降温前乙 的溶解度,则一定析出晶体,溶液质量分数一定会减少,正确;
故答案为:(1)20℃;(2)1:20;(3)降温结晶(或冷却热饱和溶液);(4)BD.
点评 此题是对溶解度知识的考查,解决的关键是利用溶解度的知识对溶液进行分析,并利用降温使溶质析出的相关知识进行解题的探讨.

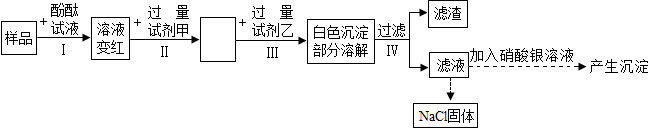
(1)样品溶液的pH大于7(填“大于”、“等于”或“小于”).
(2)甲、乙试剂选择正确的一组是B(填序号).
| 小红 | 小明 | |
| A | 甲:氯化钡 乙:稀盐酸 | 甲:硝酸钡 乙:稀硝酸 |
| B | 甲:硝酸钡 乙:稀硝酸 | 甲:氯化钡 乙:稀盐酸 |
| C | 甲:硝酸钡 乙:稀盐酸 | 甲:氯化钡 乙:稀硝酸 |
(4)小明同学步骤IV得到的滤液中除指示剂外还含有的溶质是NaCl、BaCl2、HCl.
| A. | Ca(OH)2、NaOH和H2 | B. | CaCO3、Ca(OH)2、NaOH和H2 | ||
| C. | CaCO3、NaOH、Ca(OH)2 | D. | Ca(OH)2、CaCO3和H2 |
| 元素符号 | 离子结构示意图 | 离子符号 | 它们组成的单质相互反应的化学方程式 |
| Al | Al3+ | ||
 |
 实验老师买来一瓶浓硫酸,仔细观察标签,其内容如图所示,请回答下列问题:
实验老师买来一瓶浓硫酸,仔细观察标签,其内容如图所示,请回答下列问题:
 实验室现有一种含有氯化钠的纯碱固体样品.某化学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验,测定其中纯碱的含量,并证实二氧化碳能与氢氧化钠发生化学反应.已知,该装置气密性良好,氢氧化钠溶液过量.
实验室现有一种含有氯化钠的纯碱固体样品.某化学兴趣小组的同学在老师的指导下,利用如图所示装置(部分固定装置已略去)进行实验,测定其中纯碱的含量,并证实二氧化碳能与氢氧化钠发生化学反应.已知,该装置气密性良好,氢氧化钠溶液过量.