题目内容
13.某化学实验小组加热15.5gKClO3和MnO2的混合物制取氧气,完全反应后,称得固体剩余物质量为10.7g.请计算:(1)生成氧气的质量为4.8克.
(2)小组同学从剩余固体中提纯出KCl固体(提纯过程中药品无损失),欲将其配制成溶质质量分数为10%的KCl溶液,需加多少克水?
分析 反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯化钾的质量,进一步可以计算配制成溶质质量分数为10%的KCl溶液,需加水的质量.
解答 解:(1)生成氧气的质量为:15.5g-10.7g=4.8g,
故填:4.8.
(2)设生成KCl的质量为x,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,
149 96
x 4.8g
$\frac{149}{x}$=$\frac{96}{4.8g}$,
x=7.45g,
KCl溶液的质量为:7.45g÷10%=74.5g,
加水的质量为:74.5g-7.45g=67.05g,
答:需加67.05g水.
点评 解答本题的关键是利用差量法求出氧气的质量,只要求出氧气的质量,计算就可以展开,要注意理解.

练习册系列答案
相关题目
3.不断涌现的新材料使我们的生活变得丰富多彩,制作下列生活中物品的材料一定是人们通过化学变化获取的是( )
| A. |  木质桌椅 | B. |  大理石雕塑 | C. |  黄金首饰 | D. |  塑料盆 |
8.如图是一定条件下某反应的微观模拟示意图,按图分析下列说法错误的是( )
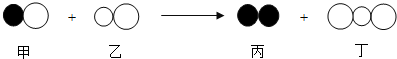

| A. | 反应前后,原子种类、数目不变 | |
| B. | 该反应中的甲、乙、丙、丁四种物质的分子个数比为2:2:1:2 | |
| C. | 该反应是置换反应 | |
| D. | 反应物和生成物都是由分子构成的 |
18.下列变化中属于化学变化的是( )
| A. | 冰雪融化 | B. | 干冰升华 | C. | 矿石粉碎 | D. | 蜡烛燃烧 |
5.二氧化硒(SeO2)中氧元素化合价为-2价,则硒元素的化合价是( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
9.下列物质之间的转化,能通过一步反应实现的是( )
①CO2→H2O ②CaO→Ca(OH)2 ③H2O2→H2O ④HNO3→HCl ⑤C→Fe.
①CO2→H2O ②CaO→Ca(OH)2 ③H2O2→H2O ④HNO3→HCl ⑤C→Fe.
| A. | ①②③④ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ②③④⑤ |
10.下列应用不正确的是( )
| A. |  氧气用于航天 | B. |  稀有气体用于闪光灯 | ||
| C. |  二氧化碳用作化工产品的原料 | D. |  聚氯乙烯塑料薄膜大棚 |

 如图是消炎药诺氟沙星胶囊的说明书.请阅读说明书回答以下问题:
如图是消炎药诺氟沙星胶囊的说明书.请阅读说明书回答以下问题: