题目内容
16.某炼铁厂用含杂质20%的赤铁矿(主要成分是Fe2O3)冶炼生铁,求1600吨这种矿石可炼出含杂质2%的生铁多少吨?分析 由赤铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
解答 解:设可炼出含杂质2%的生铁的质量为x,
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
1600t×(1-20%)(1-2%)x
$\frac{160}{112}=\frac{1600t×(1-20%)}{(1-2%)x}$ x≈914.3t.
答:可炼出含杂质2%的生铁914.3t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.

练习册系列答案
相关题目
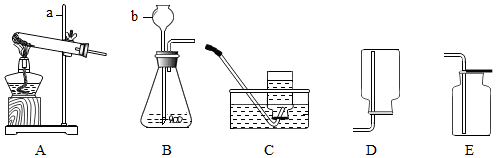
7.下列图标中为节水标志的是( )
| A. |  | B. |  | C. |  | D. |  |
11.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应前后各物质的质量如表,关于这四种物质,下列说法错误的是( )
| 物质 | a | b | c | d |
| 反应前质量/g | 5.0 | 1.2 | 2.0 | 0.5 |
| 反应后质量/g | 待测 | 3.0 | 3.6 | 0.5 |
| A. | a是反应物,b、c是生成物 | B. | 该反应为分解反应 | ||
| C. | d可能是催化剂 | D. | 反应后a的质量为3.4g |
4.同学们在帮忙老师整理实验室时,发现一瓶石灰水试剂瓶瓶壁和瓶塞周围有一些白色粉末.为了弄清楚白色粉末的成分及形成原因,他们进行了如下探究:
(1)对白色粉末成分的猜想和成因分析:
经过反复思考,同学们认为白色粉末还可能是:碳酸钙和氢氧化钙的混合物.
(2)设计实验:
甲同学取白色粉末装入试管中,加入少量的水、振荡,发现有白色固体不溶解.于是他得出粉末中一定有CaCO3的结论.乙同学查阅了溶解性表(如下表),认为甲同学的结论不严密,理由是Ca(OH)2微溶于水也可能不溶解而沉淀.
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
(3)交流与反思:
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是B(选填序号).
A、密封保存 B、使用前,临时配制 C、禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可稀盐酸.
(1)对白色粉末成分的猜想和成因分析:
| 白色粉末的成分 | 形成的原因 |
| 可能是CaCO3 | 石灰水与空气中CO2反应;化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O |
| 可能是Ca(OH)2 | 暑假气温较高,溶质的溶解度降低或溶剂蒸发,石灰水中的溶质结晶析出 |
(2)设计实验:
| OH- | Cl- | CO32- | NO3- | |
| Ca2+ | 微 | 溶 | 不 | 溶 |
为了得出较严密的结论,他们进行了如下实验,请完成下列实验报告:
| 实验步骤 | 可能观察到的现象 | 结论 |
| 取上述试管中的上层清液,滴加1~2无色酚酞试液 | 无色溶液变红 | 白色粉末含有Ca(OH)2 |
| 往上述试管中的残留的固体中加入稀盐酸 | 产生气泡 | 白色粉末中有CaCO3 |
| 由上述实验可知白色粉末的成分是:氢氧化钙、碳酸钙 | ||
①通过上述实验的探究,同学们向实验室提出保存、使用易变质的溶液时的下列建议,合理的是B(选填序号).
A、密封保存 B、使用前,临时配制 C、禁止使用这种试剂
②实验室清洗装石灰水试剂瓶内壁上的白色粉末时,可稀盐酸.
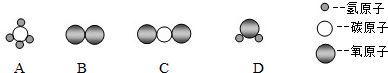

 如图是氧、镁、硫三种元素的原子结构示意图.由图可知,氧元素在化学反应中易得到电子(填“得到”或“失去”);镁元素和氧元素形成的化合物的化学式为MgO;化学性质相似的两种元素是氧和硫.
如图是氧、镁、硫三种元素的原子结构示意图.由图可知,氧元素在化学反应中易得到电子(填“得到”或“失去”);镁元素和氧元素形成的化合物的化学式为MgO;化学性质相似的两种元素是氧和硫.