题目内容
2.实验室有一瓶未知浓度的稀盐酸,为方便以后使用,某同学对其浓度进行了测定,取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4.0%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下,求:| 加入氢氧化钠的质量/g | 1.0 | 8.0 | 9.5 | 10.0 | 10.5 |
| 烧杯中溶液的pH | 1.3 | 2.0 | 3.9 | 7.0 | 9.9 |
(2)计算所测稀盐酸中溶质的质量分数.
分析 根据加入10.0g的氢氧化钠溶液恰好完全反应结合对应的化学方程式求算盐酸中溶质的质量分数.
解答 解:当加入8.0g氢氧化钠溶液时,此时溶液的pH为2.0,显酸性,所以氯化氢有剩余,溶质为生成的氯化钠和剩余的氯化氢.
恰好完全反应时消耗的氢氧化钠的质量为4.0%×10.0g=0.4g
设所测稀盐酸中溶质的质量分数为x
HCl+NaOH=NaCl+H2O
36.5 40
10gx 0.4g
$\frac{36.5}{40}$=$\frac{10gx}{0.4g}$
x=3.65%
答:(1)当滴加氢氧化钠溶液的质量为8.0g时,溶液中的溶质是 氯化钠和氯化氢.
(2)所测稀盐酸中溶质的质量分数为3.65%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
13.利用实验器材(规格和数量不限),能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 木块、木板、弹簧测力计、棉布 | 滑动摩擦力与压力的关系 |
| B | 烧杯、玻璃棒.胶头滴管、滤纸 | 用水除去二氧化锰中的氯化钾 |
| C | 长度和粗细相同但材料不同的金属丝,电源、开关、导线、滑动变阻器 | 电阻大小与材料的关系 |
| D | 烧杯、玻璃捧、pH试纸、标准比色卡、玻璃片 | 测定雨水的酸度 |
| A. | A | B. | B | C. | C | D. | D |
10.家中的食品属于酸的是( )
| A. | 食盐 | B. | 酱油 | C. | 食醋 | D. | 味精 |
17.要使如图中的气球鼓起来,则使用的固体和液体可以是( )
①石灰石和稀盐酸②镁和稀硫酸 ③氢氧化钠和水 ④生石灰和水.

①石灰石和稀盐酸②镁和稀硫酸 ③氢氧化钠和水 ④生石灰和水.
| A. | ①② | B. | ①②④ | C. | ①④ | D. | ①②③④ |
12.以下是四种微粒的结构示意图,下列有关各微粒的说法中,错误的是( )
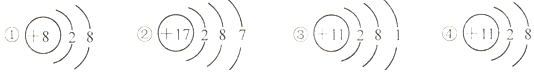

| A. | ①的化学性质比较稳定 | B. | ③④属于同种元素 | ||
| C. | ②容易得到电子 | D. | ④是一种阴离子 |
 我们的生活离不开空气.
我们的生活离不开空气.

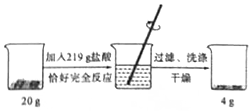 为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)
为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)