题目内容
11.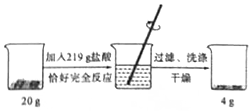 为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)
为了测定某赤铁矿石中氧化铁的质量分数,进行如下实验.请根据实验过程和提供的数据进行计算.(矿石中的杂质既不溶于水也不与盐酸反应)(1)赤铁矿石中氧化铁的质量分数;
(2)盐酸的溶质质量分数.
分析 (1)根据赤铁矿石中的杂质既不溶于水也不和酸反应,则矿石反应后固体减少的质量为矿石中氧化铁的质量,然后计算氧化铁的质量分数;
(2)根据氧化铁与一氧化碳反应的化学方程式,由反应消耗氧化铁的质量计算出参加反应的盐酸的质量分数.
解答 解:(1)赤铁矿石中氧化铁的质量分数为:$\frac{20g-4g}{20g}$×100%=80%;
(2)设参加反应的盐酸的质量为x
6HCl+Fe2O3=2FeCl3+3H2O
219 160
x 16g
$\frac{219}{x}=\frac{160}{16g}$
x=21.9g
盐酸的质量分数为:$\frac{21.9g}{219g}$×100%=10%.
故答案为:(1)80%;
(2)10%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
1.铁的下列性质中,属于化学性质的是( )
| A. | 导电性 | B. | 导热性 | C. | 可燃性 | D. | 固体 |
2.实验室有一瓶未知浓度的稀盐酸,为方便以后使用,某同学对其浓度进行了测定,取10g此盐酸于烧杯中,逐滴滴加溶质质量分数为4.0%的氢氧化钠溶液,用pH计(一种测定溶液pH的仪器)测定溶液的pH,得到的数据如下,求:
(1)当滴加氢氧化钠溶液的质量为8.0g时,溶液中的溶质是氯化钠和氯化氢.
(2)计算所测稀盐酸中溶质的质量分数.
| 加入氢氧化钠的质量/g | 1.0 | 8.0 | 9.5 | 10.0 | 10.5 |
| 烧杯中溶液的pH | 1.3 | 2.0 | 3.9 | 7.0 | 9.9 |
(2)计算所测稀盐酸中溶质的质量分数.
19.下列实验操作(或方案)不能达到实验目的是( )
| 序号 | 实验操作(或方案) | 实验目的 |
| A | 取两块干燥的玻璃片,对着其中的一块哈气 | 比较呼出的气体和空气中水蒸气的含量 |
| B | 向试管中加入2mL浓氨水,将蘸有酚酞溶液的棉花靠近该试管的管口 | 证明分子在不断运动 |
| C | 把燃着的木条伸入充满氮气的集气瓶里 | 探究氮气是否支持燃烧 |
| D | 用排水法收集气体,当导管口有气泡放出时,立即将导管伸入盛满水的集气瓶中 | 收集纯净的气体 |
| A. | A | B. | B | C. | C | D. | D |
16.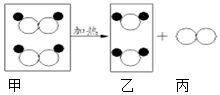 如图是某反应的微观示意图,若
如图是某反应的微观示意图,若 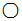 表示氧原子,
表示氧原子, 表示氢原子,有关说法不正确的是( )
表示氢原子,有关说法不正确的是( )
 如图是某反应的微观示意图,若
如图是某反应的微观示意图,若 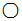 表示氧原子,
表示氧原子, 表示氢原子,有关说法不正确的是( )
表示氢原子,有关说法不正确的是( )| A. | 该反应前后分子种类、原子种类均没有改变 | |
| B. | 该反应前后原子的数目没有改变 | |
| C. | 该反应属于分解反应 | |
| D. | 图中甲、乙、丙三种物质均是由分子构成的 |
3.2011年世界水日主题是“城市用水:应对都市化挑战”.下列有关水说法正确的是( )
| A. | 淡化海水可解决淡水紧缺问题 | |
| B. | 长期饮用蒸馏水对人体的健康有利 | |
| C. | 任何溶液的溶剂都是水 | |
| D. | 水中Ca2+、Mg2+增多导致水体富营养化 |
1.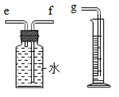 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
(1)锌与硫酸反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
请解释锌与稀硫酸反应由快变慢的原因随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
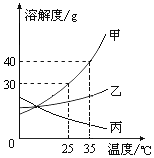 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: