题目内容
19.为了测定某赤铁矿样品(假设其中杂质不溶于水,也不与其他物质反应)中氧化铁的质量分数,小丽同学取一定质量的该矿石样品放入烧杯中,再取180g稀硫酸分三次加入烧杯中,均充分反应,实验数据如下:| 物质 | 第一次 | 第二次 | 第三次 |
| 加入稀硫酸质量(g) | 60.0 | 60.0 | 60.0 |
| 剩余固体的质量(g) | 6.8 | 3.6 | 2.0 |
(2)根据固体的质量列出求解第二次实验消耗硫酸质量(x)的比例式$\frac{160}{294}$=$\frac{3.2g}{x}$;
(3)用98%的浓硫酸配制200g上述稀硫酸,需要加入水的质量是180g;
(4)若在恰好完全反应时停止加入稀硫酸,过滤,向所得的不饱和滤液中加入42g水,则最终所得的溶液中溶质的质量分数是10.15%;
(5)用150t该矿石可制得含杂质4%的生铁的质量是87.5t.
分析 (1)根据赤铁矿的主要成分为氧化铁,氧化铁与硫酸可发生复分解反应,通过交换成分可形成硫酸铁和水进行分析;
(2)根据表中信息,每60g稀硫酸消耗氧化铁质量为6.8g-3.6g=3.2g,利用反应的化学方程式,可由氧化铁质量计算出硫酸的质量进行分析;
(3)根据稀释溶液时溶质质量不变解答;
(4)根据表中信息,每60g稀硫酸消耗氧化铁质量为6.8g-3.6g=3.2g,第三次60g稀硫酸消耗氧化铁质量为3.6g-2g=1.6g,2g为杂质质量,共消耗稀硫酸的质量为60g+60g+30g=150g,氧化铁质量3.2g×2+1.6g=8g,计算出生成的氯化铁的质量,根据溶质的质量分数计算公式即可解得;
(5)根据反应中铁元素的质量守恒来解答.
解答 解:(1)赤铁矿的主要成分为三氧化二铁,三氧化二铁与硫酸反应生成硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)根据表中信息,每60g稀硫酸消耗氧化铁质量为6.8g-3.6g=3.2g,设第二次消耗稀硫酸溶质质量为x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
3.2g x
$\frac{160}{294}$=$\frac{3.2g}{x}$
x=5.88g
稀硫酸的溶质质量分数为:$\frac{5.88g}{60g}$×100%=9.8%,
(3)需要加入水的质量是:200g-$\frac{200g×9.8%}{98%}$=180g;
(4)根据表中信息,每60g稀硫酸消耗氧化铁质量为6.8g-3.6g=3.2g,第三次60g稀硫酸消耗氧化铁质量为3.6g-2g=1.6g,2g为杂质质量,共消耗稀硫酸的质量为60g+60g+30g=150g,氧化铁质量3.2g×2+1.6g=8g,生成的氯化铁的质量为y
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 406
8g y
$\frac{160}{8g}$=$\frac{406}{y}$
y=20.3g
最终所得的溶液的质量为:8g+150g+42g=200g
则最终所得的溶液中溶质的质量分数是:$\frac{20.3g}{200g}$×100%=10.15%;
(5)根据表中信息可知,氧化铁质量3.2g×2+1.6g=8g,赤铁矿样品的质量为6.8g+3.2g=10g,根据反应中铁元素的质量守恒,10g赤铁矿样品中铁元素的质量为:8g×$\frac{56×2}{56×2+16×3}$×100%=5.6g
100t该矿石可制得铁的质量为:150t×$\frac{5.6g}{10g}$=84t,$\frac{84t}{1-4%}$=87.5t.
故答案为:(1)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(2)$\frac{294}{160}$=$\frac{x}{3.2g}$;
(3)180;
(4)10%;
(5)87.5t.
点评 这是一道常见的化学综合计算题.解题的关键在于弄清化学反应中反应物、生成物之间的关系,同时要弄清杂质在反应中存在于什么地方.第二问中关于反应后溶液中溶质的质量分数的计算,关键是要弄清反应后溶液是什么溶液.

| A. | 青蒿素中氧元素质量分数为12% | B. | 青蒿素中碳、氧元素质量比为3:1 | ||
| C. | 青蒿素属于氧化物 | D. | 一个青蒿素分子中含有42个原子 |
| A. | 常温下,过氧化氢溶液极易分解产生氧气 | |
| B. | 检验氧气是否集满的方法是用带火星的木条伸入集气瓶中 | |
| C. | 水的天然循环主要是通过物理变化完成的 | |
| D. | 原子是不可再分的 |
 2014年10月22日,2014年哈尔滨市重点工程:南岗区龙葵路跨线桥工程完成混凝土浇注.该桥建成后市民可从南岗区直线到达道里区.下列有关说法不正确的是( )
2014年10月22日,2014年哈尔滨市重点工程:南岗区龙葵路跨线桥工程完成混凝土浇注.该桥建成后市民可从南岗区直线到达道里区.下列有关说法不正确的是( )| A. | 该桥建成后,将会极大地缓解哈西地区的交通压力 | |
| B. | 建桥时用了大量的水泥和钢筋混凝土等金属材料 | |
| C. | 该桥两侧的栏杆刷油漆的主要目的是为了防锈 | |
| D. | 宽阔的柏油桥面所用的沥青是石油炼制的产品 |
| A. |  倾倒液体 | B. |  过滤 | ||
| C. |  检查气密性 | D. |  检验氧气是否收集满 检验氧气是否收集满 |
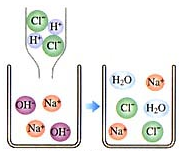 如图为某化学反应的微观模拟图,根据模拟图回答:
如图为某化学反应的微观模拟图,根据模拟图回答: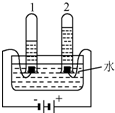 今年3月22-28日是第28届“中国水周”,其主题为“节约水资源,保障水安全.”
今年3月22-28日是第28届“中国水周”,其主题为“节约水资源,保障水安全.”