题目内容
11.(1)现有H、C、O、N四种常见的元素,请选用其中的元素写出符合初中已学物质各一种(用化学式表示):①电解水正极产生的气体O2;②溶于水后使水温降低的物质NH4NO3;
③相对分子质量最小的氧化物H2O;④雪碧等汽水中含有的一种酸H2CO3.
(2)请写出下列反应的化学方程式.
①加热碱式碳酸铜Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;
②铁丝在纯氧中燃烧3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
③盐酸除铁锈Fe2O3+6HCl═2FeCl3+3H2O,溶液由无色变为黄色.
④将少量二氧化碳通入足量石灰水中CO2+Ca(OH)2═CaCO3↓+H20 该反应后溶液的质量较反应前减少(选填“增加”、“减少”或“不变”)了.
⑤将少量硫酸铵晶体与熟石灰混合研磨:(NH4)2SO4+Ca(OH)2═CaSO4+2H2O+2NH3↑;该反应属于(填“属于”或“不属于”)复分解反应,生成的气体可用湿润的红色石蕊试纸检验.
分析 (1)首先根据题意确定物质的化学名称,然后根据题目所提供的元素、书写化学式的方法和步骤写出物质的化学式即可.
(2)根据反应物、生成物、反应条件,和化学方程式的书写步骤正确书写化学方程式.
解答 解:(1)①电解水时,正极产生的气体是氧气,故填:O2;
②硝酸铵溶于水后温度降低,故填:NH4NO3;
③水是相对分子质量最小的氧化物,故填:H2O;
④雪碧中含有碳酸,故填:H2CO3;
(2)①碱式碳酸铜在加热条件下生成氧化铜、水、二氧化碳,反应的化学方程式为:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑.故填:Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+H2O+CO2↑;
②铁丝在纯氧中燃烧生成四氧化三铁,反应的化学方程式为3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.故填:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
③铁锈的主要成分是氧化铁,与盐酸反应生成氯化铁(溶液为黄色)和水,反应的化学方程式是:Fe2O3+6HCl═2FeCl3+3H2O.故填:Fe2O3+6HCl═2FeCl3+3H2O;黄;
④二氧化碳与氢氧化钙反应生成碳酸钙和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H20;该反应后溶液的质量较反应前减少了;故填:CO2+Ca(OH)2═CaCO3↓+H20;减少;
⑤硫酸铵和氢氧化钙反应的化学方程式为:(NH4)2SO4+Ca(OH)2═CaSO4+2H2O+2NH3↑,该反应是由两种化合物相互交换成分生成两种新的化合物属于复分解反应;常用于检验氨气的存在(能使湿润的红色石蕊试纸);故填:(NH4)2SO4+Ca(OH)2═CaSO4+2H2O+2NH3↑;属于;湿润的红色石蕊试纸.
点评 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在;解题时应注意只能从给出的元素中选择来组成物质.

 名校课堂系列答案
名校课堂系列答案| A. | H2O | B. | 2H | C. | H2SO4 | D. | H2 |
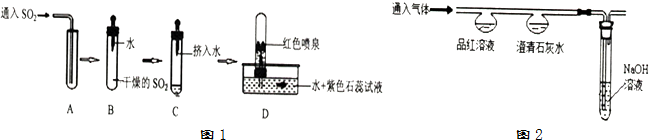
探究一:SO2的制取
(1)实验室常用固体亚硫酸钠(Na2SO3)与稀硫酸在常温下反应制取二氧化硫,选择发生装置主要应该考虑的因素是AB(填序号,可多选).
A、反应物的状态 B、反应条件 C、气体密度 D、气体溶解性
(2)探究二氧化硫性质,该兴趣小组进行了如图1所示的实验
通过上述实验,可推测SO2气体的性质有:①二氧化硫密度比空气大;②二氧化硫能溶于水.
探究二:CO2和SO2性质的比较
兴趣小组设计并进行如图2的实验,探究比较CO2和SO2的化学性质.
| 实验Ⅰ | 实验Ⅱ | |
| 通入CO2 | 通入SO2 | |
| 品红溶液 | 无明显变化 | 红色褪为无色 |
| 澄清石灰水 | 白色浑浊 | 白色浑浊 |
①二氧化硫能与澄清石灰水反应,生成亚硫酸钙(CaSO3)和水,写出该反应的化学方程式Ca(OH)2+SO2═CaSO3↓+H2O.
②鉴别CO2和SO2的方法是将气体分别通入品红溶液,红色褪去的是二氧化硫,无明显变化的是二氧化碳.
③实验Ⅱ中NaOH溶液的作用是吸收尾气,防止其污染空气.
探究三 测定空气中SO2的含量,探究小组进行如下实验
【查阅资料】①碘水遇淀粉变蓝色
②二氧化碳与碘水反应的化学方程式为:SO2+I2+2H2O═H2SO4+2HI(SO2、I2的相对分子质量分别为64.254)
③我国环境空气质量标准中对每次空气质量测定中SO2最高浓度限值
| SO2最高浓度限值(单位mg/m3) | ||
| 一级标准 | 二级标准 | 三级标准 |
| 0.15 | 0.50 | 0.70 |
Ⅰ.检查装置的气密性
Ⅱ.向试管中加入1g溶质质量分数为0.0127%的碘水,用适量的蒸馏水稀释,再滴入2-3滴淀粉溶液,配制成稀溶液.
Ⅲ.在指定地点用注射器抽取空气140次注入上述试管中(假设每次抽气500mL)由实验可知:
①当溶液由蓝色变成无色时反应恰好完全
②由此可计算空气中SO2的含量0.46mg/m3(结果精确至0.01),所测地点的空气中SO2的含量属于二级标准(填如表中所列举的等级).
| A. | 相等 | B. | 甲大于乙 | C. | 甲小于乙 | D. | 无法比较 |
 2013年度诺贝尔化学奖获得者的研究成 果是“发展多尺度模型研究复杂化学体系”,化学家们用计算机做“帮手”来揭示化学过程.晶体硅是制造计算机必不可少的材料,如图是硅元素的部分信息.下列有关说法正确的是( )
2013年度诺贝尔化学奖获得者的研究成 果是“发展多尺度模型研究复杂化学体系”,化学家们用计算机做“帮手”来揭示化学过程.晶体硅是制造计算机必不可少的材料,如图是硅元素的部分信息.下列有关说法正确的是( )| A. | 相对原子质量为14 | B. | Si在地壳中含量最高 | ||
| C. | 单质硅不能用作导体 | D. | 原子核外有14个电子 |
 铜、铁、铝作为金属材料一直被广泛应用.
铜、铁、铝作为金属材料一直被广泛应用.
 某科学小组用实验室中NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数.实验步骤如下:
某科学小组用实验室中NaOH溶液测定空气中酸性气体(CO2、SO2)的体积分数.实验步骤如下: