题目内容
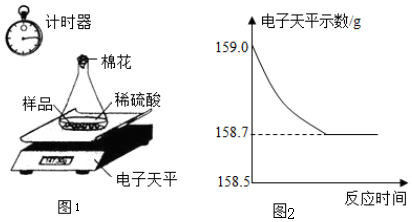
20. 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:①称量a g胆矾固体放入烧杯中,加水配制成溶液,向其中滴加氢氧化钠溶液至沉淀完全,过滤;②把步骤①中的滤渣转移至蒸发皿中,加热至全部变成黑色氧化铜为止;③过滤、洗涤、干燥、称量所得固体质量为b g;④分别取一定质量的上述氧化铜固体和氯酸钾固体混合均匀,如图所示,加热、收集反应生成的氧气.
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:①称量a g胆矾固体放入烧杯中,加水配制成溶液,向其中滴加氢氧化钠溶液至沉淀完全,过滤;②把步骤①中的滤渣转移至蒸发皿中,加热至全部变成黑色氧化铜为止;③过滤、洗涤、干燥、称量所得固体质量为b g;④分别取一定质量的上述氧化铜固体和氯酸钾固体混合均匀,如图所示,加热、收集反应生成的氧气.请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是①②③④(填写序号).
(2)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10,简述用pH试纸测定溶液的酸碱度时pH试纸的实验操作用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读数.
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验后还应该进行的实验操作是cadbe(按实验先后顺序填写字母序号).
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解 的实验中起催化作用.你认为还应该进行的另一个实验是另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢.
分析 (1)根据在配制溶液时用玻璃棒的作用、蒸发时玻璃棒的作用、过滤时玻璃棒的作用来考虑本题;(2)根据pH试纸的用法考虑;(3)需要证明反应前后氧化铜的质量不变,反应后需根据氧化铜不溶于水,氯化钾溶于水的性质先将其分离,得到纯净干燥的氧化铜,再进行称量;(4)通过对比实验才能知道到底是否加快了反应速度.
解答 解:(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌,所以选择①②③④;
(2)pH试纸的用法:用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读出数值即可;
(3)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(4)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
故答案为:(1)①②③④;(2)用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读数;(3)cadbe;(4)另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢.
点评 将不溶于液体中的固体和液体分离的一种方法是过滤,由于氧化铜不溶于水,氯化钾溶于水,所以用过滤法分离两种物质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.如图是甲、乙两物质的溶解度曲线.下列说法中正确的是( )


| A. | 若将t1℃时的甲、乙的饱和溶液升温至t2℃时,乙溶液中溶质的质量分数将大于甲溶液中溶质的质量分数 | |
| B. | t2℃时,甲、乙的饱和溶液中含有的溶质质量甲等于乙 | |
| C. | 若将t3℃的甲、乙的饱和溶液分别降温到t2℃时,甲、乙两溶液中均有晶体析出 | |
| D. | 当甲中混有少量乙时,可采用冷却热饱和溶液的方法提纯 |
8.用食盐晶体配制溶质质量分数一定的氯化钠溶液,应选用的一组仪器是( )
①量筒 ②酒精灯 ③玻璃棒 ④托盘天平 ⑤蒸发皿 ⑥烧杯.
①量筒 ②酒精灯 ③玻璃棒 ④托盘天平 ⑤蒸发皿 ⑥烧杯.
| A. | ②③⑤⑥ | B. | ①③⑤⑥ | C. | ①③④⑥ | D. | ①④⑤⑥ |
12.烧杯中盛有一定质量、温度为60℃的KNO3溶液,将其置于室温环境中,测定不同温度时析出晶体的质量,测定结果记录如表.若不考虑水蒸发对实验的影响,请回答下列问题
(1)30℃时,该溶液是否为饱和溶液?是(选填“是”“否”或“无法判断”)
(2)在某一温度时,将接近饱和的KNO3溶液变成饱和溶液,下列方法中一定可行的是②③⑤(填序号)
①升温 ②降温 ③加溶质 ④加水 ⑤恒温蒸发水.
| 溶液的温度/℃ | 50 | 40 | 30 | 20 |
| 析出固体的质量/g | 0 | 0 | 2.0 | 8.4 |
(2)在某一温度时,将接近饱和的KNO3溶液变成饱和溶液,下列方法中一定可行的是②③⑤(填序号)
①升温 ②降温 ③加溶质 ④加水 ⑤恒温蒸发水.
9.工业制取硅的其中一步反应原理是SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,该反应属于基本反应类型中的( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |

 如图,用红磷燃烧来测定空气中氧气的含量,此反应的文字表达式为磷+氧气$\stackrel{点燃}{→}$五氧化二磷.这个实验可以得出氧气约占空气体积的$\frac{1}{5}$的结论,还可以推论瓶中剩余气体难(填“易”或“难”)溶于水和其化学性质不活泼(填“活泼”或“不活泼”).
如图,用红磷燃烧来测定空气中氧气的含量,此反应的文字表达式为磷+氧气$\stackrel{点燃}{→}$五氧化二磷.这个实验可以得出氧气约占空气体积的$\frac{1}{5}$的结论,还可以推论瓶中剩余气体难(填“易”或“难”)溶于水和其化学性质不活泼(填“活泼”或“不活泼”).