题目内容
13.A-G是初中常见的物质.其中E为黑色固体.如图为这些物质的转化关系图,其中部分生成物和反应条件已省略.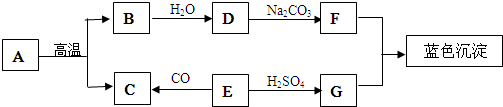
(1)写出下列物质的化学式:ECuO,FNaOH.
(2)化学反应常伴有能量变化.B与水反应时会放出(“吸收”或“放出”)热量.
(3)实验室不用A与稀硫酸反应来制取C,原因是反应生成的CaSO4微溶于水,包在CaCO3表面,阻止反应继续进行.
(4)写出D→F的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
分析 根据题干叙述,A高温能生成B和C,故A可能碳酸钙,生成的B和C是氧化钙和二氧化碳,B能与水反应生成的,故B可能是氧化钙,D是氢氧化钙,氢氧化钙能与碳酸钠反应生成F,F能与G反应生成蓝色沉淀,故F是氢氧化钠,F是硫酸铜,E能与硫酸反应生成硫酸铜,故E是氧化铜,氧化铜能与一氧化碳反应生成铜和二氧化碳,据此解答.
解答 解:根据图框:A高温能生成B和C,故A可能碳酸钙,生成的B和C是氧化钙和二氧化碳,B能与水反应生成的,故B可能是氧化钙,D是氢氧化钙,氢氧化钙能与碳酸钠反应生成F,F能与G反应生成蓝色沉淀,故F是氢氧化钠,F是硫酸铜,E能与硫酸反应生成硫酸铜,故E是氧化铜,氧化铜能与一氧化碳反应生成铜和二氧化碳,带入框图,推断合理;
(1)根据分析,E是氧化铜,F是氢氧化钠,故其化学式分别为:CuO,NaOH;
(2)根据分析,B可能是氧化钙,氧化钙与水反应生成氢氧化钙会放出热量,故填:放出;
(3)根据分析,A可能碳酸钙,C为二氧化碳,而碳酸钙与硫酸反应生成的CaSO4微溶于水,包在CaCO3表面,阻止反应继续进行,故填:反应生成的CaSO4微溶于水,包在CaCO3表面,阻止反应继续进行;
(4)反应D→F,即氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故其化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
故答案为:
(1)CuO,NaOH;(2)放出;
(3)反应生成的CaSO4微溶于水,包在CaCO3表面,阻止反应继续进行;
(4)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
点评 本题为框图式物质推断题,解答本题的关键是找准解题的突破口,直接得出有关物质的化学式,然后根据框图结合物质的性质推断得出其他物质的化学式.

练习册系列答案
相关题目
4.化学与生活、生产密切相关.下列说法中正确的是( )
| A. | 低血糖发作时,吃馒头比喝葡萄糖水见效快 | |
| B. | 草木灰和碳酸氢铵是常用肥料,将两者混合施用可增加肥效 | |
| C. | 煤矿井里常含有可燃性气体,所以须保持良好通风并严禁烟火 | |
| D. | 人体中缺乏钙、铁等元素会引发多种疾病,所以饮食中摄入得越多越好 |
8.某同学对一袋化肥的成分进行了探究,请你参与探究并填空:
提出问题:该化肥中含有什么物质?
收集信息:经询问得知,该化肥可能为铵态氮肥,且可能混入了其他化肥,所谓铵态氮肥指的是含有NH4+(填离子符号)的盐.
提出猜想:该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
实验、记录与分析:
实验结论:若该化肥中只含有一种阳离子,则其中一定含有的物质是NH4Cl和(NH4)2SO4(写化学式).
实验反思:小红提出在步骤(2)中用氯化钡溶液代替硝酸钡溶液,小明立即否定了这种做法,理由是对氯离子的鉴别产生干扰.
提出问题:该化肥中含有什么物质?
收集信息:经询问得知,该化肥可能为铵态氮肥,且可能混入了其他化肥,所谓铵态氮肥指的是含有NH4+(填离子符号)的盐.
提出猜想:该化肥所含的阴离子可能是Cl-、CO32-、SO42-中的一种或几种.
实验、记录与分析:
| 实验操作步骤 | 实验现象 | 实验分析 |
| (1)取少量该化肥样品和少量熟石灰放在研钵(填仪器名称)中混合研磨 | 有氨味或有刺激性气味 | 含有铵根离子 |
| (2)另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加稀硝酸,过滤. | 有白色沉淀产生,无气泡,沉淀不溶解 | 没有存在CO32- 存在,有SO42-存在 |
| (3)取(2)所得滤液少量于试管中,滴加硝酸银溶液和稀硝酸. | 产生白色沉淀 | 有Cl- |
实验反思:小红提出在步骤(2)中用氯化钡溶液代替硝酸钡溶液,小明立即否定了这种做法,理由是对氯离子的鉴别产生干扰.
2.下列符号中数字表示的意义正确的是( )
| A. | Fe2+:“2+”表示一个铁离子带两个单位的正电荷 | |
| B. | 2Na:“2”表示两个钠元素 | |
| C. | $\stackrel{+2}{Mg}$:“+2”表示镁离子带有两个单位正电荷 | |
| D. | 3CO2:“2”表示一个二氧化碳分子含有两个氧原子 |



