题目内容
2.5%的氢氧化钠溶液800g与足量的磷酸溶液反应,参加反应的磷酸(H3PO4)质量是多少?(化学方程式:3NaOH+H3PO4═Na3PO4+3H2O)分析 根据化学方程式,利用氢氧化钠的质量就可以求出参加反应的磷酸的质量.
解答 解:设参加反应的磷酸(H3PO4)质量是x
3NaOH+H3PO4═Na3PO4+3H2O
120 98
800g×5% x
$\frac{120}{800×5%}$=$\frac{98}{x}$
x=32.7g
答:参加反应的磷酸质量是32.7g.
点评 本题难度不是很大,主要考查了根据化学方程式的计算,培养学生分析问题的能力和解决问题的能力.

练习册系列答案
相关题目
12.将锌粉、铝粉、铁粉、和镁粉混合物159g与一定质量浓度为35%的硫酸溶液恰好完全反应,蒸干水分得固体(不含结晶水)639g,反应中产生H2质量可能为( )
| A. | 10g | B. | 49g | C. | 159g | D. | 480g |
13.氧气是空气的主要成分之一,下列有关氧气的说法正确的是( )
| A. | 鱼类能在水中生存,证明氧气易溶于水 | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 收集满氧气的集气瓶正放在实验桌上,因为通常状况下氧气的密度比空气的密度大 | |
| D. | 工业上用分离液态空气的方法制取氧气,利用了氧气的沸点比氮气的沸点低 |
10.某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,不溶于水,也不含氯化钠).把产生的所用氨气用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如表:
氯化铵与氢氧化钠加热条件下发生反应方程式为NH4Cl+NaOH=NaCl+H2O+NH3↑
氨气与硫酸反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4
回答下列问题:
(1)产生氨气的质量1.7克.
(2)样品中氯化铵的质量分数为多少?
(3)反应后得到的氯化钠溶液的溶质质量分数为多少?(不考虑反应过程中水分的损失)
| 时间(S) | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量(g) | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
氨气与硫酸反应的化学方程式为:2NH3+H2SO4=(NH4)2SO4
回答下列问题:
(1)产生氨气的质量1.7克.
(2)样品中氯化铵的质量分数为多少?
(3)反应后得到的氯化钠溶液的溶质质量分数为多少?(不考虑反应过程中水分的损失)
17.除去下列物质中的杂质,所选用的方法正确的是( )
| 物质(括号内为杂质) | 搡作方法 | |
| A | CO2(HCl) | 先通过过量氧化钠溶液,再通过浓硫酸 |
| B | NaCl溶液(Na2CO3) | 加稀硫酸恰好不再产生气泡为止 |
| C | CuSO4溶液(H2SO4) | 加过量氧化铜粉末充分反应后过滤 |
| D | 铁粉(铜粉) | 加过量FeSO4溶液充分反应后过滤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
7.除去如表物质中的少量杂质,所选用的试剂及操作方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CO2(CO) | 氧气 | 点燃 |
| B | KCl(K2SO4) | 蒸馏水和过量氯化钡溶液 | 溶解、过滤、蒸发 |
| C | NH3(H2O) | 足量的浓硫酸 | 洗气 |
| D | Cu(CuO) | 足量的稀硫酸 | 浸泡、过滤、洗涤、干燥 |
| A. | A | B. | B | C. | C | D. | D |
14.将硫酸渣中金属元素进行分离的一种工艺 流程如图所示.

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
Ⅱ.25℃时,Al(OH)3可溶于pH>6.0的碱溶液,并转化为AlO2-
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?

【查阅资料】
Ⅰ.相关数据
25℃时,氢氧化物沉淀的pH范围
| Fe(OH)3 | Al(OH)3 | Mg(OH)2 | |
| 开始沉淀时的pH | 1.5 | 3.3 | 10.4 |
| 沉淀完全时的pH | 3.2 | 5.2 | 12.4 |
【流程分析】
(1)在实验室完成操作①需要的玻璃仪器有烧杯、玻璃棒和漏斗.
(2)所加稀盐酸必须过量的原因是使硫酸渣完全溶解.
(3)向溶液A中加入试剂M调节pH到7的过程中,沉淀的颜色会经历“红褐色变淡,再变深的过程”的过程,出现该现象的原因是氢氧化钠会与氯化铁反应生成氢氧化铁沉淀,氢氧化铁沉淀会溶于酸,盐酸消耗完后,氢氧化铁沉淀的沉淀量会逐渐增多,颜色变深.
(4)溶液B中加入试剂M调节pH=13时,发生反应的化学方程式是AlCl3+4NaOH=NaAlO2+2H2O+3NaCl,MgCl2+2NaOH=Mg(OH)2↓+2NaCl.
(5)高温灼烧固体X时,X能在保持各元素的化合价不变的前提下分解为两种氧化物,该反应的化学方程式是2Fe(OH)3$\frac{\underline{\;高温\;}}{\;}$Fe2O3+3H2O.
(6)如果操作②是蒸发结晶,则不可能得到纯净的NaAlO2固体,理由是溶液C中含有反应生成的氯化钠.
Ⅲ.1000t该硫酸渣含铁的质量分数37.75%,经过充分处理后,最多可以冶炼得到含杂质4%的生铁多少吨?
12.选择铸造硬币的金属材料不需要考虑的因素是( )
| A. | 耐腐蚀性 | B. | 导电性 | C. | 价格 | D. | 硬度 |
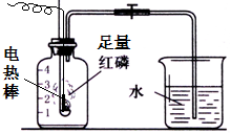 按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题:
按如图组装仪器,关闭止水夹,通电使红磷燃烧.请回答下列问题: