题目内容
4.如图为某加碘食盐包装袋上的部分文字(I为碘的元素符号).由此你得到的信息和作出的猜测是( )
| A. | 加碘食盐中的“碘”是碘单质 | |
| B. | 碘酸钾中K、I、O三元素的化合价分别为1+、5+、2- | |
| C. | 碘酸钾的相对分子质量为182 | |
| D. | 氯化钠中钠元素的质量分数约为39.3% |
分析 A、由标签上的配料表,加“碘”盐中含有碘酸钾,据此进行分析判断.
B、根据元素化合的表示方法进行分析判断.
C、根据相对分子的质量为组成分子的各原子的相对原子质量之和,进行分析解答.
D、某元素质量分数=$\frac{该原子的相对原子质量×该原子个数}{该物质的相对分子质量}$×100%.
解答 解:A、由标签上的配料表,加“碘”盐中含有碘酸钾(KIO3),碘在碘酸钾中不是以单质形式存在的,是以元素形式存在,故选项说法错误.
B、根据在化合物中正负化合价代数和为零,K元素的化合价为+1,氧元素的化合价为-2,碘元素的化合价为+5,故选项说法错误.
C、根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得碘酸钾的相对分子质量为:39+127+16×3=214,故选项说法错误.
D、氯化钠中钠元素的质量分数为:$\frac{23}{23+35.5}$×100%≈39.3%.故选项说法正确.
故选:D.
点评 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
2.生产和生活中使用的某些合金,是不同种金属在熔化状态下熔合后的.下表所列出的几种金属中,难以与其他金属形成合金的是钨.
几种金属在标准大气压下的熔点和沸点
几种金属在标准大气压下的熔点和沸点
| 金 属 | 铁 | 铜 | 银 | 金 | 钨 |
| 熔点(℃) | 1535 | 1083 | 962 | 1064 | 3410 |
| 沸点(℃) | 2750 | 2595 | 2212 | 2707 | 5627 |
13.化学与社会关系密切,下列说法有误的是( )
| A. | 生活中常见的有机物有甲烷、乙醇、乙酸、葡萄糖、蛋白质、苏打等 | |
| B. | 家用电器着火可用干粉灭火器扑灭 | |
| C. | 对人体有害的物质有甲醛、黄曲霉素、重金属、亚硝酸钠等 | |
| D. | 造成温室效应的气体主要就是CO2,还有氟氯烃(CFC〕、甲烷、低空臭氧、和氮氧化物气体等 |
14. 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
(1)用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具有脱水性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其吸水性.
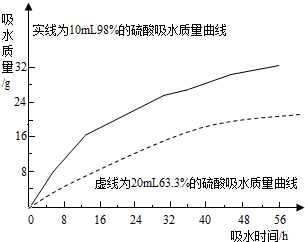
(2)探究浓硫酸的吸水性.兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析.根据室温环境下实验的数据绘成的曲线如右图:
①稀释浓硫酸时,应将浓硫酸缓缓地注入盛有水的烧杯中并不断搅拌;
②由如图曲线你能得到的实验结论有哪些?(写两点)浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)、开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
(3)探究浓硫酸能否使铁钝化(钝化指在表面形成氧化膜保护层,使内层金属不再发生变化).可选用的实验药品有:相同铁片若干、浓硫酸、稀硫酸、硫酸铜溶液等.实验仪器任选.
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整.
你认为方案Ⅱ与方案Ⅰ相比,方案Ⅱ的优点是采用了对比实验的方法,更科学.
②某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明:加热条件下,氧化膜被破坏(被浓硫酸溶解),铁继续与浓硫酸反应.(或热的浓硫酸能与铁反应产生刺激性气体;或热的浓硫酸不能使铁钝化;或铁的钝化随条件的改变而改变;或铁与浓硫酸的作用与温度有关)(其它合理答案均可).除产生该气体外,同时还生成硫酸铁和水,请写出反应的化学方程式:2Fe+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑.
 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:(1)用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色,这主要是由于浓硫酸具有脱水性,使纸中的纤维素炭化的缘故;在洗气瓶中盛放浓硫酸,除去氢气或氧气中的水分,是利用其吸水性.
(2)探究浓硫酸的吸水性.兴趣小组把98%的硫酸10mL和63.3%的硫酸(用10mL98%的硫酸与10mL水配成)约20mL分别放入两个相同的大表面皿中,称量、观察、记录、分析.根据室温环境下实验的数据绘成的曲线如右图:
①稀释浓硫酸时,应将浓硫酸缓缓地注入盛有水的烧杯中并不断搅拌;
②由如图曲线你能得到的实验结论有哪些?(写两点)浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)、开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
(3)探究浓硫酸能否使铁钝化(钝化指在表面形成氧化膜保护层,使内层金属不再发生变化).可选用的实验药品有:相同铁片若干、浓硫酸、稀硫酸、硫酸铜溶液等.实验仪器任选.
①兴趣小组已经完成下表实验Ⅰ和Ⅱ,请你帮他们将实验报告补充完整.
| 方案 | 实验假设 | 实验方案 | 实验现象与结论 |
| Ⅰ | 能发生钝化 | 取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中. | 无明显变化,假设成立. |
| Ⅱ | 能发生钝化 | 取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中. | 浸过浓硫酸的铁片表面无明显变化,另一铁片表面产生红色固体,假设成立. |
②某同学将一铁片插入盛有98%的浓硫酸的试管中,无明显变化,再给试管加热一段时间后,发现溶液变色并有刺激性气味气体产生,此现象说明:加热条件下,氧化膜被破坏(被浓硫酸溶解),铁继续与浓硫酸反应.(或热的浓硫酸能与铁反应产生刺激性气体;或热的浓硫酸不能使铁钝化;或铁的钝化随条件的改变而改变;或铁与浓硫酸的作用与温度有关)(其它合理答案均可).除产生该气体外,同时还生成硫酸铁和水,请写出反应的化学方程式:2Fe+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑.


 所表示的粒子符号为S,容易得(“失”或“得”)电子,此原子形成离子的符号S2-.
所表示的粒子符号为S,容易得(“失”或“得”)电子,此原子形成离子的符号S2-.