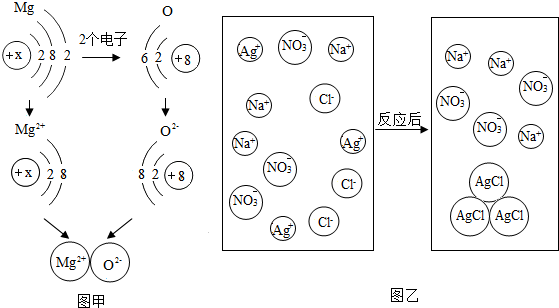
题目内容
16.利用沉淀法可测定某粗盐样品的纯度(假定粗盐中的杂质全部是MgCl2).每次取1000g样品配制成溶液,向其中加入10%的氢氧化钠溶液,测得生成沉淀的质量与所加氢氧化钠溶液的质量关系如表所示:| 测定次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 样品质量(g) | 1000 | 1000 | 1000 | 1000 |
| 氢氧化钠溶液质量(g) | 320 | 640 | 820 | 900 |
| 沉淀质量(g) | 23.2 | 46.4 | 58 | 58 |
分析 根据产生沉淀氢氧化镁的质量可以计算氯化镁的质量,根据氯化镁的质量可以计算氯化钠的质量,进一步可以计算粗盐的纯度.
解答 解:设样品中MgCl2的质量为x,与氢氧化钠反应生成氯化钠的质量为y,
MgCl2+2NaOH═2NaCl+Mg(OH)2↓,
95 117 58
x y 58g
$\frac{95}{x}$=$\frac{117}{y}$=$\frac{58}{58g}$
x=95g
y=117g
粗盐的纯度为:$\frac{1000g-95g}{1000g}$×100%═90.5%
答:样品中粗盐的纯度90.5%.
故答案为:90.5%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
6.下列各组物质的检验、鉴别中,所选试剂不正确的是( )
| 实验任务 | 鉴别试剂 | |
| A | 检验二氧化碳和氮气 | 燃着的木条 |
| B | 鉴别硬水与软水 | 肥皂水 |
| C | 检验某化肥是否为铵态氮肥 | 浓氢氧化钠溶液、红色石蕊试纸 |
| D | 鉴别稀盐酸和稀硫酸 | 硝酸钡溶液 |
| A. | A | B. | B | C. | C | D. | D |
4.对图所示实验现象分析正确的是( )
| A. |  实验中试管内液面上升,说明试管内压强增大 实验中试管内液面上升,说明试管内压强增大 | |
| B. |  实验中小气球迅速胀大,说明NaOH能与CO2反应 实验中小气球迅速胀大,说明NaOH能与CO2反应 | |
| C. | 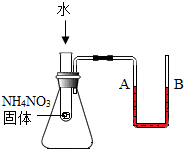 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 实验中U型管内液面左高右低,说明NH4NO3能与水发生反应 | |
| D. | 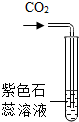 实验中紫色石蕊溶液变红,说明CO2是一种酸 实验中紫色石蕊溶液变红,说明CO2是一种酸 |
11. 甲、乙、丙、丁是初中化学常见的物质.其中甲、丁是红色固体,单质乙是一种常见且用途广泛的金属,组成乙的元素在地壳中含量仅次于铝,丙为最轻的气体.已知它们间的转化关系如图所示.下列有关说法,错误的是( )
甲、乙、丙、丁是初中化学常见的物质.其中甲、丁是红色固体,单质乙是一种常见且用途广泛的金属,组成乙的元素在地壳中含量仅次于铝,丙为最轻的气体.已知它们间的转化关系如图所示.下列有关说法,错误的是( )
 甲、乙、丙、丁是初中化学常见的物质.其中甲、丁是红色固体,单质乙是一种常见且用途广泛的金属,组成乙的元素在地壳中含量仅次于铝,丙为最轻的气体.已知它们间的转化关系如图所示.下列有关说法,错误的是( )
甲、乙、丙、丁是初中化学常见的物质.其中甲、丁是红色固体,单质乙是一种常见且用途广泛的金属,组成乙的元素在地壳中含量仅次于铝,丙为最轻的气体.已知它们间的转化关系如图所示.下列有关说法,错误的是( )| A. | 转化①有多种途径,其中一种常用于冶金工业 | |
| B. | 完成转化④,物质丙的实际用量要大于理论用量 | |
| C. | 由转化③可知金属活动性顺序:乙>丁 | |
| D. | 完成转化②,所得溶液呈黄色 |
14.根据下列仪器装置,回答有关问题.
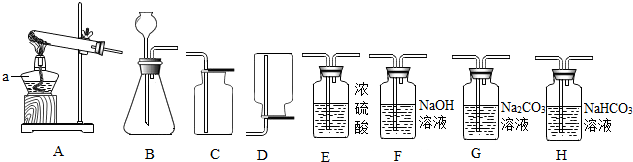
(1)制取氧气.实验室选用装置A制取氧气时,用到的化学药品是KClO3和MnO2(用化学式表示);收集氧气可以选用的装置是C填装置序号).实验结束熄灭酒精灯的操作为用灯帽盖灭(盖灭后轻提下灯帽).
(2)制取二氧化碳.用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为(B)→H→(E)→干燥、纯净CO2 (在括号内填装置序号).
(3)进一步探究二氧化碳与氢氧化钠溶液的反应.
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3.向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3═Na2CO3+H2O;Ca(HCO3)2溶于水.
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④Na2CO3和NaOH.
【实验】请你参与下列验证猜想③的实验,完成探究报告.
【讨论】二氧化碳通入一定量的氢氧化钠溶液,影响反应后生成物成分的决定因素
是通入二氧化碳的量多少.

(1)制取氧气.实验室选用装置A制取氧气时,用到的化学药品是KClO3和MnO2(用化学式表示);收集氧气可以选用的装置是C填装置序号).实验结束熄灭酒精灯的操作为用灯帽盖灭(盖灭后轻提下灯帽).
(2)制取二氧化碳.用一定浓度的盐酸与石灰石反应制取二氧化碳气体,发生反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O.为制得干燥、纯净的二氧化碳气体,所选装置的连接顺序为(B)→H→(E)→干燥、纯净CO2 (在括号内填装置序号).
(3)进一步探究二氧化碳与氢氧化钠溶液的反应.
【提出问题】制取干燥、纯净的二氧化碳气体流程中,选用装置H而不用G,因为碳酸钠溶液中通入二氧化碳发生反应:Na2CO3+CO2+H2O═2NaHCO3.向氢氧化钠溶液中通入一定量二氧化碳后,所得溶液中溶质是什么?
【查阅资料】碳酸氢钠与氢氧化钠发生反应:NaOH+NaHCO3═Na2CO3+H2O;Ca(HCO3)2溶于水.
【猜想】所得溶液中的溶质是:
①Na2CO3;②NaHCO3;③Na2CO3和NaHCO3;④Na2CO3和NaOH.
【实验】请你参与下列验证猜想③的实验,完成探究报告.
| 步骤和方法 | 现象 | 分析 |
| 取少量反应后的溶液,加入足量的CaCl2溶液 | 产生白色沉淀 | 发生反应的方程式: CaCl2+Na2CO3=CaCO3↓+2NaCl |
| 过滤,向滤液中加入少量NaOH溶液 | 产生白色沉淀 | 结论:猜想③正确 |
是通入二氧化碳的量多少.
15.下列图象能正确反映相应操作过程的是( )
| A. |  稀释等质量溶质质量分数分别为30%和10%的H2SO4溶液 | |
| B. |  等质量的锌粉和铁粉,分别与质量分数相同的足量稀盐酸反应 | |
| C. |  在恒温条件下,将饱和的氯化钠溶液恒温蒸发水分至有白色晶体析出 | |
| D. |  向氯化铜和硝酸铜的混合溶液中滴加氢氧化钠溶液 |
 A、B、C、D、E为五种不同类别的物质,他们之间的反应关系如图所示,其中A和B中含有相同的金属元素,D和E中含有另一种相同的金属元素,A是一种红色固体物质,D的水溶液为蓝色.“→”表示相邻的物质之间可以转化(部分反应物、生成物、反应条件略去)“-”表示相连的物质之间在一定条件可以发生反应.请回答下列问题.
A、B、C、D、E为五种不同类别的物质,他们之间的反应关系如图所示,其中A和B中含有相同的金属元素,D和E中含有另一种相同的金属元素,A是一种红色固体物质,D的水溶液为蓝色.“→”表示相邻的物质之间可以转化(部分反应物、生成物、反应条件略去)“-”表示相连的物质之间在一定条件可以发生反应.请回答下列问题.