题目内容
10.请根据图所示的实验过程和提供的数据,回答下列问题:208.6g不饱和溶液Na2CO3和NaCl的混合物样品13
(1)生成二氧化碳的质量为4.4g,稀盐酸的溶质质量分数为7.3%.
(2)计算原混合物样品中氯化钠的质量(写出计算过程).
(3)该实验实际测得的氯化钠质量往往会有偏差,其原因可能是二氧化碳部分溶解在水中(或与水反应)、有少量水蒸气进入空气等.
分析 (1)根据质量守恒定律反应前后减少的质量即为生成二氧化碳的质量;
(2)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,然后结合题中的数据进行解答;
(3)根据实验实际测得的氯化钠质量往往会有偏差,其原因可能是二氧化碳部分溶解在水中(或与水反应)、有少量水蒸气进入空气等解答.
解答 解:(1)反应生成CO2的质量为13g+100g+100g-208.6g=4.4g;
(2)设样品中Na2CO3质量为x,稀盐酸的溶质为y,生成NaCl质量为z,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 73 117 44
x y z 4.4g
$\frac{106}{x}=\frac{44}{4.4g}$
x=10.6g
$\frac{73}{y}=\frac{44}{4.4g}$
y=7.3g
稀盐酸的溶质质量分数为:$\frac{7.3g}{100g}×$100%=7.3%
氯化钠的质量为:13g-10.6g=2.4g
(3)该实验实际测得的氯化钠质量往往会有偏差,其原因可能是二氧化碳部分溶解在水中(或与水反应)、有少量水蒸气进入空气等.
答案:
(1)4.4 7.3%
(2)混合物中氯化钠的质量为2.4g
(3)二氧化碳部分溶解在水中(或与水反应)、有少量水蒸气进入空气等.
点评 要想解答好这类题目,首先要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等,然后根据所给的问题情景或图表信息等,结合所学的相关知识和技能,细致地分析题意(或图表信息)等各种信息资源,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.点燃的蜡烛在如图甲所示密闭装置内燃烧一段时间后会自动熄灭,用仪器测出这一过程中瓶内氧气含量的变化如图乙所示.下列判断正确的是( )


| A. | 蜡烛燃烧前装置内只有氧气 | |
| B. | 蜡烛熄灭后瓶内只剩二氧化碳气体 | |
| C. | 过程中装置内物质总质量不断减少 | |
| D. | 氧气含量小于一定值时,蜡烛无法燃烧 |
18.下列微粒符号中,对“2”的含义理解正确的是( )
| A. | 2Cu中的“2”表示2个铜元素 | |
| B. | Fe2+中的“2”表示每个亚铁离子带有2个单位的正电荷 | |
| C. | H2S中的“2”表示1个硫化氢分子中含 有2个硫原子 | |
| D. | S2-表示-2价的硫元素 |
5.已知碳的两种氧化物:一氧化碳、二氧化碳.某气体由碳氧两种元素组成,其中碳氧两种元素的质量比3:5,则该气体为.( )
| A. | 一定是纯净物 | B. | 一定是混合物 | C. | 可能是混合物 | D. | 可能是纯净物 |
15.向ZnO和Fe2O3的混合物24.1g中加入稀硫酸至恰好溶解,再向所得溶液中加入KOH溶液至恰好沉淀完全,生成Zn(OH)2和Fe(OH)3沉淀的总质量为31.3g,则参加反应的KOH的质量为( )
| A. | 11.2g | B. | 22.4g | C. | 44.8g | D. | 89.6g |
2. 某学习小组对硫酸进行如下研究:
某学习小组对硫酸进行如下研究:
(1)图中仪器①的名称为分液漏斗,发生反应的化学方程式为Zn+H2SO4 ═ZnSO4+H2↑.该装置也可用于实验室制二氧化碳气体(任写一种),化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)已知相同温度下,硫酸的质量分数越大溶液的酸性越强.常温下10%的稀硫酸的pH<2%的稀硫酸(填“>”、“<”或“=”).若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有BC(填字母).
A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
(3)向两个烧杯中分别注入浓硫酸(溶质质量分数为98%,密度为1.84g/mL)和稀硫酸(浓硫酸与水的体积比1:1)各10mL,称量并记录不同时间(h)两种硫酸溶液吸水的质量(g),数据见下表:
①体积比为1:1稀硫酸的溶质质量分数计算表达式为$\frac{v×1.84g/c{m}^{3}×98%}{v×1.84g/c{m}^{3}+v×1g/c{m}^{3}}$×100%.若量取浓硫酸时俯视读数,则所配稀硫酸的溶质质量分数将偏小(填“偏大”、“偏小”或“不变”).
②由表中实验数据可知:
a.有关硫酸吸水性的说法不正确的是B(填字母).
A.浓、稀硫酸都有吸水性 B.只有浓硫酸有吸水性 C.浓硫酸吸水性较稀硫酸强
b.实验室保存稀硫酸时要密封存放,在干燥气体时应选用浓硫酸作干燥剂(填“浓”或“稀”).
 某学习小组对硫酸进行如下研究:
某学习小组对硫酸进行如下研究:(1)图中仪器①的名称为分液漏斗,发生反应的化学方程式为Zn+H2SO4 ═ZnSO4+H2↑.该装置也可用于实验室制二氧化碳气体(任写一种),化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)已知相同温度下,硫酸的质量分数越大溶液的酸性越强.常温下10%的稀硫酸的pH<2%的稀硫酸(填“>”、“<”或“=”).若对稀硫酸进行如下操作,溶液的pH因化学变化而升高的有BC(填字母).
A.加少量水 B.加少量铁粉 C.加少量氢氧化钾 D.加少量浓硫酸
(3)向两个烧杯中分别注入浓硫酸(溶质质量分数为98%,密度为1.84g/mL)和稀硫酸(浓硫酸与水的体积比1:1)各10mL,称量并记录不同时间(h)两种硫酸溶液吸水的质量(g),数据见下表:
| 时间/h | 1 | 1.5 | 4 | 8 | 12 | 24 | 48 | 60 | |
| 吸水 质量/g | 浓硫酸 | 1.6 | 2.2 | 5.2 | 10.3 | 14.0 | 20.9 | 29.2 | 32.1 |
| 稀硫酸 | 1.2 | 1.5 | 3.5 | 5.9 | 8.1 | 12.9 | 19.5 | 21.0 | |
②由表中实验数据可知:
a.有关硫酸吸水性的说法不正确的是B(填字母).
A.浓、稀硫酸都有吸水性 B.只有浓硫酸有吸水性 C.浓硫酸吸水性较稀硫酸强
b.实验室保存稀硫酸时要密封存放,在干燥气体时应选用浓硫酸作干燥剂(填“浓”或“稀”).
19. 如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.
如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.
(1)经访问有关人员,了解到这样包装的目的是为了防止食品挤压变形或食品腐败,且从经济性、环保等因素考虑,工厂使用的包装气体是空气,氮气或二氧化碳.请你以此调查结果为依据,对包装气体的成分提出猜想,并说明你猜想的依据:
(2)请设计实验,检验上述猜想的正确性.填写下列实验报告:
(3)你认为食品充气包装,对所充气体的要求是:①无毒②与食品不反应③价廉易得.
 如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.
如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.(1)经访问有关人员,了解到这样包装的目的是为了防止食品挤压变形或食品腐败,且从经济性、环保等因素考虑,工厂使用的包装气体是空气,氮气或二氧化碳.请你以此调查结果为依据,对包装气体的成分提出猜想,并说明你猜想的依据:
| 我对气体的猜想是 | |
| 我猜想的依据是 |
| 实验方法及操作 | 可能观察到的现象及结论 |
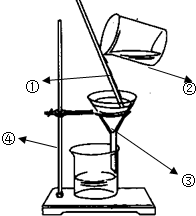 (1)指出图中所标的仪器的名称
(1)指出图中所标的仪器的名称