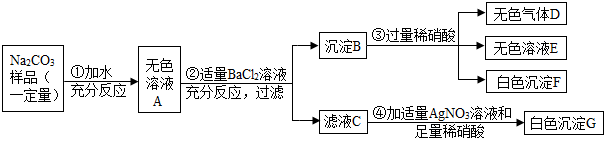
题目内容
19.纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到.加热
【查阅资料】硫酸铝铵晶体的化学式为Al2(NH4)2(SO4)4•24H2O,相对分子质量为906,Al2(NH4)2(SO4)4•24H2O═Al2O3+2NH3↑+4SO3↑+25H2O,硫酸铝铵的溶解度随温度升高而增大;H2O2能将Fe2+氧化为Fe3+;含Fe3+的溶液中滴入KSCN溶液,溶液变为血红色.
(1)制备硫酸铝铵晶体的实验流程如下:
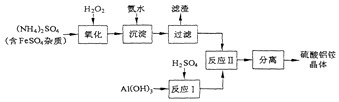
①上述流程中“过滤”所得滤渣是Fe(OH)3(写化学式),检验过滤后杂质是否除尽的实验方法是取少量反应后的溶液与试管中,滴入KSCN溶液,如果溶液不变色,说明杂质已经除尽,如果溶液变为血红色,说明杂质没有除尽.
②反应 I中的反应方程式为:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O.
③上述流程中,“分离”所包含的操作依次为:加热浓缩、降温结晶、过滤、洗涤、干燥.
(2)取4.53g 硫酸铝铵晶体加热分解,最终剩余 Al2O3固体的质量为多少?
分析 (1)硫酸亚铁能被过氧化氢氧化成硫酸铁,硫酸铁能和氨水反应生成氢氧化铁沉淀;
氢氧化铝和稀硫酸反应生成硫酸铝和水;
上述流程中,“分离”所包含的操作依次为:加热浓缩、降温结晶、过滤、洗涤、干燥.
(2)根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)①上述流程中“过滤”所得滤渣是Fe(OH)3;
检验过滤后杂质是否除尽的实验方法是:取少量反应后的溶液与试管中,滴入KSCN溶液,如果溶液不变色,说明杂质已经除尽,如果溶液变为血红色,说明杂质没有除尽.
故填:Fe(OH)3;取少量反应后的溶液与试管中,滴入KSCN溶液,如果溶液不变色,说明杂质已经除尽,如果溶液变为血红色,说明杂质没有除尽.
②反应 I中,氢氧化铝和稀硫酸反应生成硫酸铝和水,反应的反应方程式为:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O.
故填:2Al(OH)3+3H2SO4═Al2(SO4)3+6H2O.
③上述流程中,“分离”所包含的操作依次为:加热浓缩、降温结晶、过滤、洗涤、干燥.
故填:降温结晶.
(2)设最终剩余 Al2O3固体的质量为x,
Al2(NH4)2(SO4)4•24H2O═Al2O3+2NH3↑+4SO3↑+25H2O,
906 102
4.53g x
$\frac{906}{4.53g}$=$\frac{102}{x}$,
x=0.51g,
答:最终剩余 Al2O3固体的质量为0.51g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
10.如图为利用炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉制备黄铜(铜和锌的合金)的生产流程.下列说法正确的是( )


| A. | 操作X的名称是溶解 | |
| B. | 气体A一定为为纯净物 | |
| C. | 向黄铜中加入稀盐酸,会产生气泡 | |
| D. | 加热过程中一定有元素的化合价发生了改变 |
7. 中国科学院院士张青莲教授主持测定了铕、铱等近十种院士的相对原子质量,为相对原子质量测定作出了卓越贡献.下列关于铕的说法中正确的是( )
中国科学院院士张青莲教授主持测定了铕、铱等近十种院士的相对原子质量,为相对原子质量测定作出了卓越贡献.下列关于铕的说法中正确的是( )
 中国科学院院士张青莲教授主持测定了铕、铱等近十种院士的相对原子质量,为相对原子质量测定作出了卓越贡献.下列关于铕的说法中正确的是( )
中国科学院院士张青莲教授主持测定了铕、铱等近十种院士的相对原子质量,为相对原子质量测定作出了卓越贡献.下列关于铕的说法中正确的是( )| A. | 相对原子质量为152.0 | B. | 属于非金属元素 | ||
| C. | 原子核外电子数为89 | D. | 原子序数为63 |
14.化学肥料对粮食增产起着重要作用,下列能作磷肥的是( )
| A. | NH4HCO3 | B. | CO(NH2)2 | C. | Ca(H2PO4)2 | D. | KNO3 |
4.将一定质量的铜锌合金的粉末加入到一定量的硝酸银溶液中充分反应后过滤,向滤渣中滴加少量的稀盐酸,有气泡产生,下列说法正确的是( )
| A. | 滤液中的溶质一定含有硝酸铜 | B. | 滤液中溶质一定不含硝酸银 | ||
| C. | 滤渣中可能含有银和锌 | D. | 滤渣中一定没有铜 |
8.某兴趣小组的同学利用如图装置进行实验,研究二氧化碳与氢氧化钠反应.
(1)步骤二中实验前需检查装置气密性:用手捂住试管外壁,说明装置的气密性良好的现象是导管口有气泡冒出.
(2)实验一和实验二的步骤一中,均观察到的现象是气球变大.
(3)能证明二氧化碳与氢氧化钠反应的现象是实验1澄清石灰水未变浑浊、实验2澄清石灰水变浑浊,实验二的作用是对比.
(4)写出二氧化碳与氢氧化钠反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
| 装置内容 | 【实验1】 | 【实验2】 |
步骤一 | 锥形瓶中为预先收集满的二氧化碳气体,加入足量浓氢氧化钠溶液立即塞紧橡皮塞,静止一段时间 | 锥形瓶中为预先收集满的二氧化碳气体,加入等量水立即紧橡皮塞,静止一段时间 |
步骤二 | 取上述溶液少量于试管中,按如图所示装置连接好仪器,加热并通入澄清的石灰水. | 取上述溶液少量于试管中,按如图所示装置连接好仪器,加热并通入澄清的石灰水. |
(2)实验一和实验二的步骤一中,均观察到的现象是气球变大.
(3)能证明二氧化碳与氢氧化钠反应的现象是实验1澄清石灰水未变浑浊、实验2澄清石灰水变浑浊,实验二的作用是对比.
(4)写出二氧化碳与氢氧化钠反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
9.家用燃气泄漏会引起爆炸,下列气体中与空气混合遇到明火会发生爆炸的是( )
| A. | 氧气 | B. | 二氧化碳 | C. | 甲烷 | D. | 氮气 |